“Neymiş bu kanser immünoterapisi?” başlıklı yazıda bağışıklık sistemi ile kanser arasındaki ilişkiden ve günümüzde en sık uygulama alanı bulan immünoterapi yöntemi olan antikor tedavilerinden bahsederek hücresel tedavilerle ilgili kısmı bir sonraki yazıya bırakmıştım. Bu yazıda, kanser tedavisinde büyük umutlar veren bu hücresel immünoterapi uygulamalarının bazılarını tanıtmak ve Sabancı Üniversitesi’ndeki laboratuvarımızda, Nova Southeastern University’den Dr. Adil Doğanay Duru ile iş birliğimiz sonucu geliştirdiğimiz yeni bir immünoterapi yaklaşımı olan TCR-NK hücrelerinden bahsetmek istiyorum. Bu vesileyle bu araştırmalarda BAGEP 2017 ödülüyle bana destek olan Bilim Akademisi’ne teşekkürü de bir borç bilirim.
Bağışıklık sistemimiz birçok farklı hücre tipinden ve bu hücreler tarafından salgılanan moleküllerden oluşur. Bağışıklık sistemi hücrelerimizin hepsi kemik iliğindeki kan kök hücrelerinden gelişir ve farklı görevleri yapmak için özelleşirler. Kanımızda ve dokularımızda dolaşan bu farklı hücre tipleri fiziksel özelliklerine ve yaptıkları görevlere göre gruplandırılır. Bu gruplamaya göre insan bağışıklık sisteminde 3 farklı beyaz kan hücresi vardır: B hücreleri, T hücreleri ve NK (Natural Killer – Doğal Öldürücü) hücreleri.
B hücreleri, antikor moleküllerini sentezleyerek salgılayan hücreler (Bkz Neymiş bu kanser immünoterapisi?), T ve NK hücreleri ise katil hücreler olarak bilinirler ve diğer hücreleri öldürme fonksiyonuna sahipler [1]. Katil hücrelerin görevi vücuda girmiş olabilecek yabancı hücreleri, enfeksiyon geçirmekte olan hücreleri ve kansere dönüşmeye başlayan hücreleri öldürmek. Her iki hücre tipinde de öldürme işlemi benzer mekanizmalarla yapılır. T veya NK hücrelerinin içinde zehirli moleküllerle dolu küçük kesecikler var ve bu kesecikler öldürülmek istenen hedef hücrenin üzerine doğru salgılanır. Salgılanan bu zehirli moleküller hedef hücre içerisine girerek hücre ölümünü tetikler. T ve NK hücreleri aynı mekanizmalarla öldürseler de, karşılarına çıkan hangi hücreyi öldürüp hangi hücreyi öldürmeyeceklerine dair kullandıkları karar mekanizmaları birbirinden farklıdır.
Katil hücreler
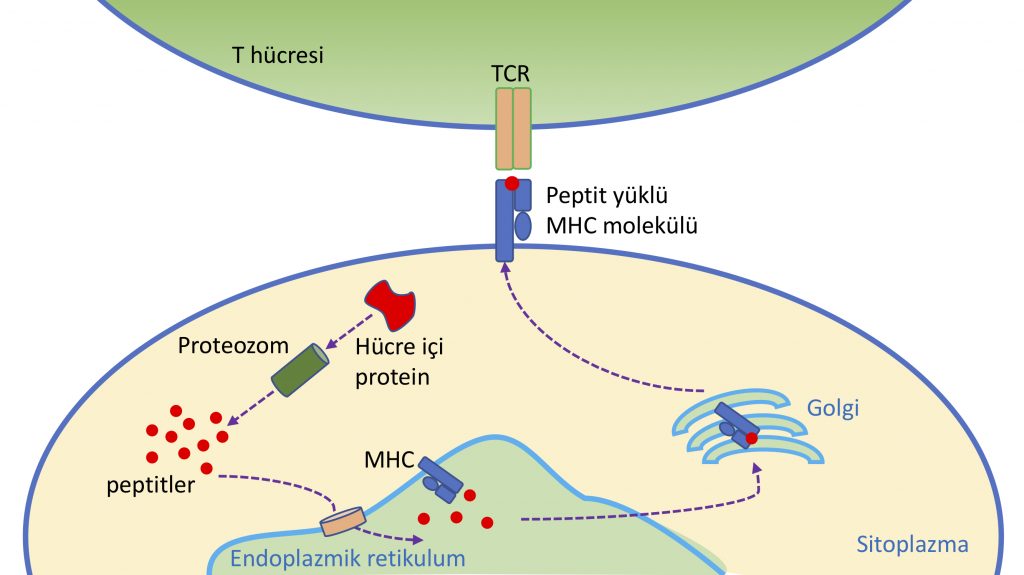
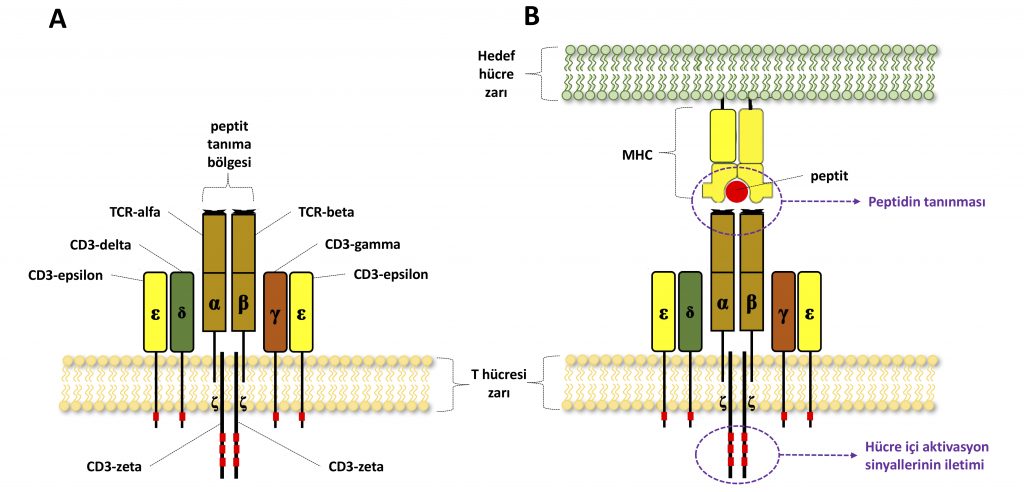
T hücrelerinin yüzeyinde bulunan TCR (T cell receptor) molekülü hedef hücrenin tanınmasında önemli rol oynar (Şekil 1). TCR sayesinde hedef hücrenin içine doğru bir pencere açılabilir. Bu pencere, tüm hücrelerimizde var olan bir nevi kalite kontrol mekanizmasının parçası. Bu kalite kontrol sisteminde, hücre içinde üretilen tüm proteinler peptit ismi verilen küçük parçalara ayrılıyor ve bu peptitler MHC (major histocompatibility complex – büyük doku uyuşmazlığı kompleksi) ismi verilen bir proteine bağlanarak hücre yüzeyine taşınıyor. Hücre yüzeyinde, MHC moleküllerine bağlı şekilde sunulan peptitler karşı taraftaki T hücresinin yüzeyindeki TCR tarafından tanınıyor. TCR, bu bağlanma sırasında MHC üzerinde sunulmakta olan peptidin organizmanın kendisine mi yoksa yabancı bir organizmaya mı ait olduğunu ayırt edebilecek mekanizmalara sahip. Bu tanıma sayesinde, mesela hedef hücre içindeki bir virüse ait proteinler TCR tarafından algılanarak içerisinde virüs taşıyan hücreler öldürülebiliyor. Benzer şekilde genlerdeki mutasyonlardan kaynaklanan yeni peptit dizileri de TCR tarafından yabancı olarak tanınarak kanser hücrelerinin öldürülmesine sebebiyet verebiliyor. Yani, MHC molekülünü bir kimlik kartı gibi düşünecek olursak T hücreleri için kimlik kontrolü yapıyor diyebiliriz.
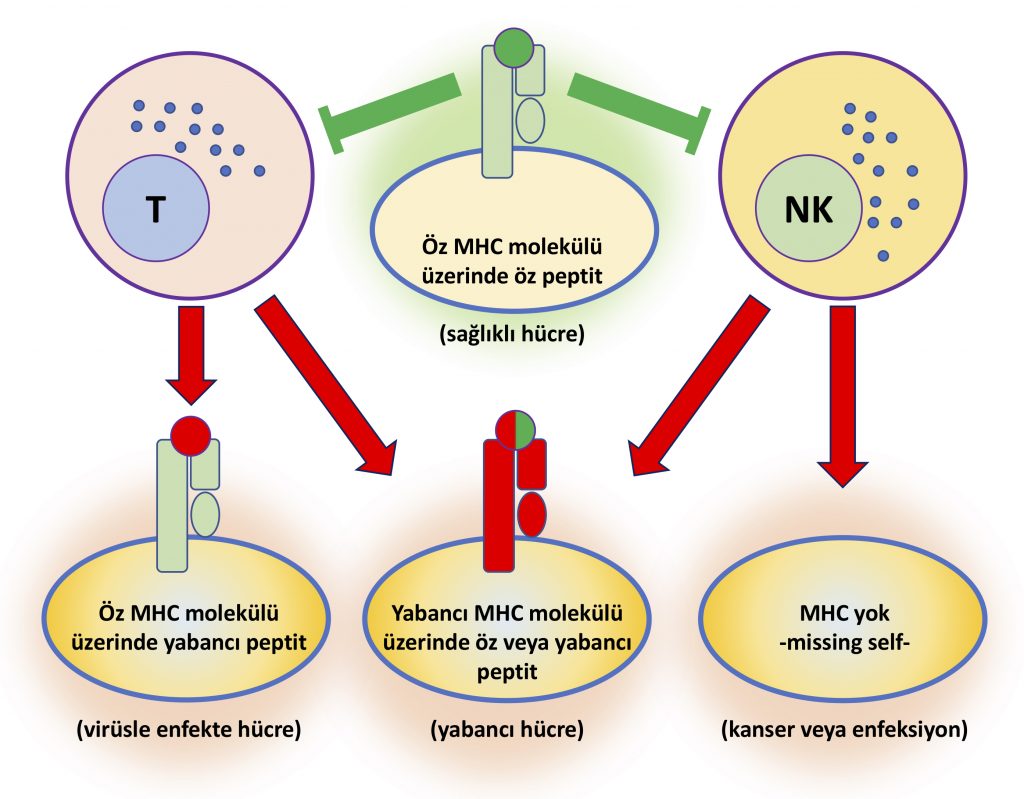
NK hücreleri için de MHC molekülünün özel bir önemi var, fakat onlar kimliğin üstünde yazan isimden daha çok kimliğin var olup olmamasıyla ilgilenirler. NK hücrelerinin hedefteki hücreyi öldürüp öldürmemesi konusunda karar vermesindeki en önemli etken hedef hücre yüzeyinde MHC molekülü bulunup bulunmaması. Normalde tüm sağlıklı hücrelerin yüzeyinde MHC molekülü bulunur ve bu sayede T hücreleri gerekli kontrolü yapabilirler fakat olur da bu kontrol mekanizması bozulursa, yani hedef hücre yüzeyinde MHC molekülü bulunmazsa, o zaman devreye NK hücreleri girer. NK hücreleri bir emniyet supabı gibi görev yaparak yüzeylerinde MHC bulunmayan hücreleri, yani T hücrelerinden kaçmaya çalışanları öldürürler[2].
Özet olarak, T hücreleri MHC üzerinde sunulan peptitler vasıtasıyla spesifik moleküllere tepki verebilirken, NK hücreleri ise MHC yokluğuna genel bir tepki veren hücreler olarak karşımıza çıkıyor. Bu sayede T ve NK hücreleri birbirlerini mükemmel bir şekilde tamamlayarak farklı tehlikelere karşı vücudumuzu koruma altında tutabilirler. Bu iki hücre tipinin dayanışması ve iş birliğiyle bağışıklık sistemimiz birçok farklı senaryoya karşı vücudumuzu koruyabiliyor (Şekil 2).
Katil hücreler tedavide nasıl kullanılır?
Hem T hem de NK hücreleri hastalardan veya vericilerden alınıp laboratuvar ortamında çoğaltılarak tedavi amacıyla hastaya geri verilebiliyor. Bu tip uygulamalarda başarı görülse de tümörün etkin bir şekilde ve minimum yan etkiyle yok edilebilmesi için birçok durumda bu T ve NK hücrelerinin spesifik olarak tümörü hedefleyecek şekilde genetik olarak modifiye edilmesi tercih edilir.
Günümüzde, bu genetik modifikasyon için kullanılabilecek iki farklı teknoloji var: TCR genlerinin veya CAR (chimeric antigen receptor) genlerinin transferi. Bu teknolojilerin çalışma mekanizmasını anlayabilmek için için öncelikle TCR’nin doğal yapısını ve çalışma şeklini gözden geçirmeliyiz.
T hücresi reseptörü (TCR)
TCR aslında yapısında 6 farklı protein bulunduran, yani 6 farklı gen tarafından kodlanan büyük bir kompleks. Şekil 3’te bu 6 farklı proteinin bir araya gelip oluşturduğu TCR’nin yapısını ve hedef hücre yüzeyindeki MHC tarafından sunulan peptitlerle etkileşimini görüyoruz. Buna göre, TCR’nin MHC’ye bağlanıp peptiti tanımasını sağlayan kısımları TCR-alfa ve TCR-beta proteinleri. TCR-alfa/beta ikilisinin etrafında ise CD3-delta, CD3-gama, CD3-epsilon ve CD3-zeta isimli 4 proteinden oluşan bir yapı var. Bu yapının içerisinde özellikle CD3-zeta proteini TCR tarafından algılanan sinyallerin T hücresi içine iletilmesinden sorumlu.
Eğer hedef hücre yüzeyinde yabancı bir peptit tespit edilirse CD3-zeta yoluyla aktarılan sinyaller sayesinde T hücresinin aktivasyonu sağlanır.
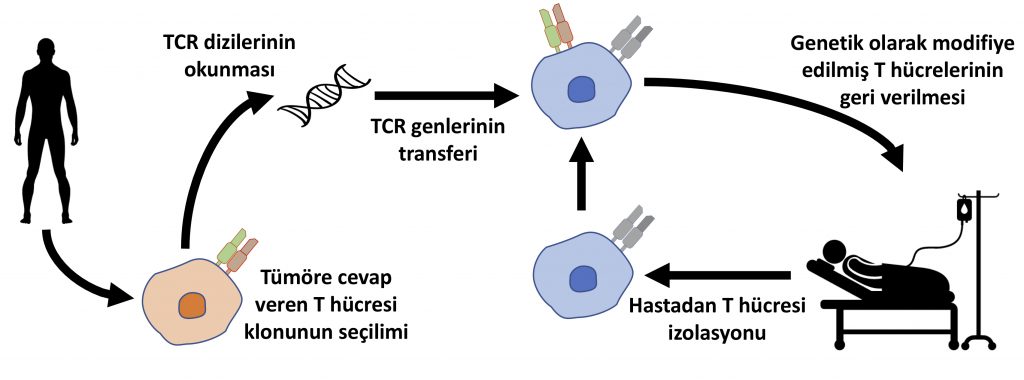
Kanserde etkili olması için T hücrelerinin spesifik tümör antijenlerine yönlendirilmesi önemli. Bu yüzden TCR genlerinin transferi gündeme geldi. Bu yaklaşımda, öncelikle kanser moleküllerini tanıyan TCR-alfa ve TCR-beta gen dizilerinin tespit edilmesi gerekli. Bu diziler genellikle hastaların tümörlerinden alınan T hücrelerinin kodladıkları TCR’lerin okunmasıyla bulunuyor. Bir hastadan bu şekilde büyütülen T hücresi klonlarından keşfedilen TCR dizileri aynı zamanda veritabanlarında depolanıyor ve bu sayede tümörün içindeki T hücrelerinden TCR dizilerinin keşfi her hasta için tekrar tekrar yapılmak zorunda olan bir prosedür olmaktan çıkıyor.
Tanımlanan bu TCR dizileri tedavi amacıyla Şekil 4’te gösterilen şekilde kullanılıyor. Bu tedavi yaklaşımında hastadan izole edilen poliklonal (yani her biri kendi farklı TCR’sini taşıyan) T hücrelerine laboratuvar ortamında tümörü spesifik olarak tanıyacak olan TCR-alfa ve TCR-beta genleri nakledilir. Bu ikinci TCR’yi yüzeylerinde taşıyan hastanın T hücreleri kanseri spesifik olarak tanıyacak şekilde programlanmış olur ve hastaya geri verildiğinde tümörle savaşabilme yeteneğine sahiptir.
TCR-T hücrelerindeki problemler
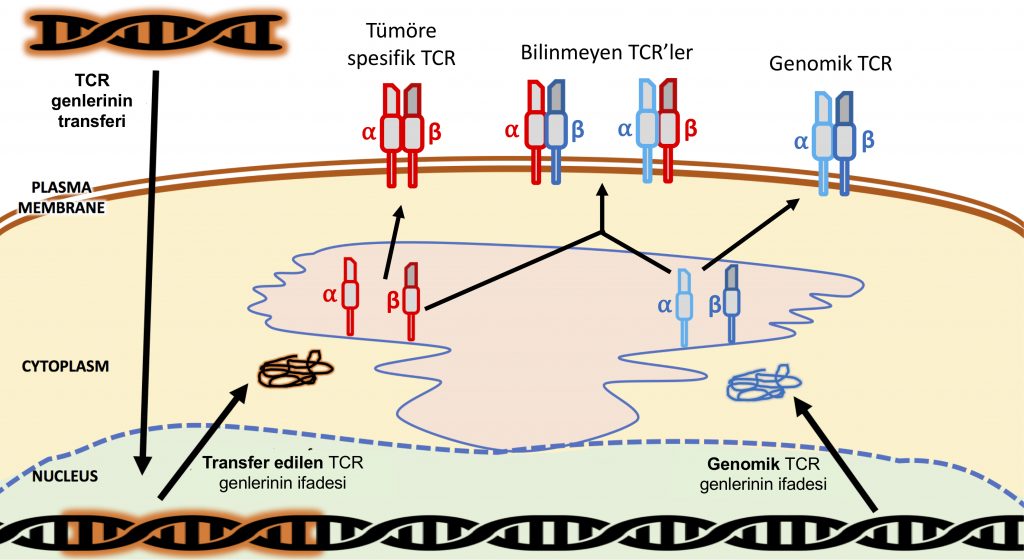
Teorik olarak bu şekilde planlanan TCR gen transferi yaklaşımlarında TCR molekülünün kompleks yapısı yüzünden bazı ciddi problemler ortaya çıkıyor. Yukarıda da bahsettiğimiz gibi TCR kompleksi esasen, TCR-alfa, TCR-beta, CD3-delta, CD3-gama, CD3-epsilon ve CD3-zeta zincirlerinden oluşan büyük bir kompleks. Bu kompleks içerisinde TCR alfa/beta zincirleri hedef hücre yüzeyinde MHC üzerinde sunulmakta olan peptidin spesifik olarak tanınmasından sorumludur. T hücrelerine TCR genlerinin aktarımı sırasında dışarıdan verilen TCR-alfa ve TCR-beta genlerinden üretilen proteinlerin, T hücresinin kendi genomundaki TCR dizilerinden zaten sentezlenmekte olan TCR-beta ya da TCR-alfa zincirleriyle eşleşme riski vardır. Bu olgu yanlış eşleşme problemi olarak adlandırılıyor ve hangi hedef molekülü tanıyacağı bilinmeyen, potansiyel olarak hayati yan etkileri olabilecek yeni TCR’ler oluşturma riski var. Bu risk (Şekil 5) TCR teknolojisine dayalı tedavilerin önünde büyük bir engel teşkil ediyor. Yanlış eşleşme sorununu çözmek için birçok yöntem denenmiş olsa da bugüne kadar T hücrelerinde bu problemi ortadan tamamen kaldıracak yüzde yüz verimli bir teknoloji henüz bulunamadı.
Chimeric antigen receptor (CAR) teknolojisi
TCR-T hücrelerinde yaşanan bu gibi problemler yüzünden bu hücrelerin klinik kullanımı beklendiği kadar ilerleme gösteremedi ve ilgi alternatif bir yöntem olarak geliştirilen CAR teknolojisine kaydı.
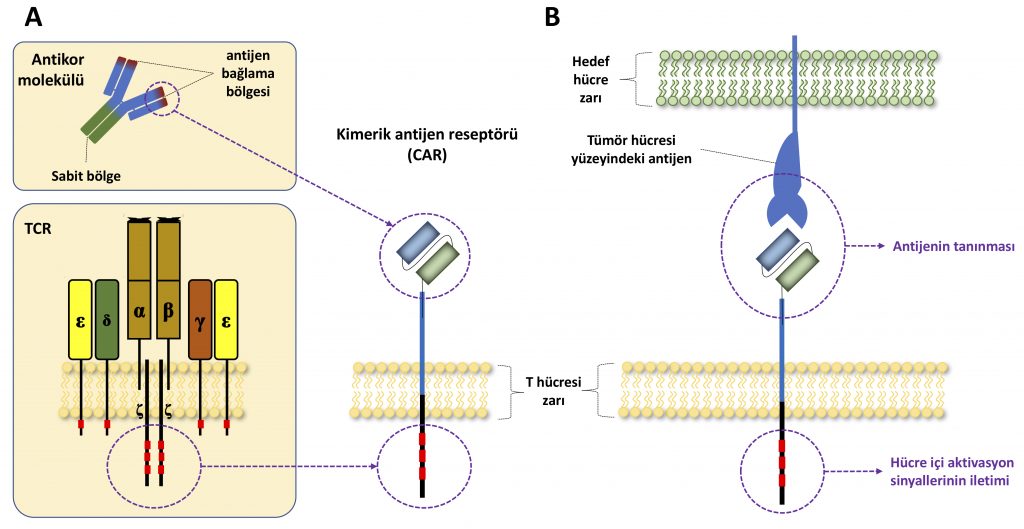
CAR genleri, normalde hücrelerimiz tarafından kodlanmayan özel bir reseptörü kodlayan genler. Genetik mühendisliği yöntemleriyle tasarlanırlar ve bağışıklık sistemi hücrelerimize aktarılırlar. Bu teknoloji geliştirilirken hem TCR molekülünün hücre içi sinyal özelliklerinden hem de antikorların spesifik moleküllere bağlanabilme özelliğinden faydalanıldı (Şekil 6). [3]
Ana fikir olarak CAR teknolojisi Şekil 6’da anlatıldığı en basit şekliyle çalışıyor. Bu şekilde dizayn edilen CAR genlerinin T hücrelerine nakli sonrası tümör hücrelerinin yüzeyindeki hedeflerin spesifik olarak tanınması ve bu tanıma sonrası CD3-zeta tarafından T hücresi aktivasyonunun tetiklenmesi mümkün oluyor. Bu sayede spesifik bir tümör antijenini hedefleyecek şekilde genetik olarak modifiye edilmiş olan CAR-T hücrelerinin hastalara geri verilmesi sonrası görülen cevaplar oldukça olumlu. 2018 yılı içerisinde dünyada ilk defa olmak üzere 2 farklı şirketin CAR-T hücresi tedavileri hem Amerika’da hem de Avrupa’da sağlık otoritelerinden ruhsat alarak hastaların kullanımına sunuldu. Öte yandan birçok farklı kanser türünde değişik antijenlere karşı geliştirilen CAR-T hücreleri de klinik denemelerde test ediliyor ve ilerleyen yıllarda onlarca yeni CAR-T hücresi tedavisinin daha ruhsatlanarak hastaların hizmetine sunulması bekleniyor.
CAR genleri, T hücrelerine aktarıldığında çalıştığı gibi NK hücrelerine aktarıldığı zaman da aynı mekanizmayla çalışıyor ve NK hücrelerinin, tümör hücrelerinin yüzeyindeki antijenlere hedeflenebilmesi için oldukça verimli bir yöntem olarak karşımıza çıkıyor. Bu yöntemin çalışmasında en önemli etkenlerden birisi CAR dizaynında kullanılan hücre içi CD3-zeta sinyallerinin NK hücrelerini aktive etmekte de aynı verimliliği göstermesi. Bu şekilde tümöre spesifik hale getirilen CAR-NK hücreleri klinik denemelerde oldukça olumlu sonuçlar veriyor ve CAR-T hücreleri gibi ilerleyen yıllarda birçok CAR-NK hücresi tedavisinin de ruhsatlanarak hastaların hizmetine sunulması bekleniyor.
Bu yöntemler nerede yetersiz kalıyor?
CAR-T ve CAR-NK hücrelerinin giderek yaygınlaşan kullanımları sayesinde tümör hücrelerinin yüzeylerindeki antijenlerin spesifik olarak hedeflenmesi konusunda büyük ilerleme kaydedildi ve CAR teknolojisine dayanan birçok yeni tedavi yöntemi geliştiriliyor. Fakat tümöre spesifik hedefleme yapmak için ne antikor tedavilerinin ne de CAR tedavilerinin ulaşabildiği büyük bir potansiyel halen yeterince verimli bir şekilde kullanılamıyor. Yukarıda da bahsettiğimiz gibi TCR gen transferi kullanılarak hücre içindeki antijenlerin hedeflenmesine dair yaklaşımlar T hücrelerindeki yanlış eşleşme problemi yüzünden yeteri kadar gelişemedi.
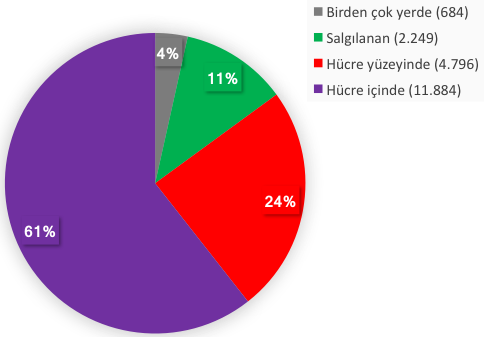
İnsan hücrelerinde 20.000 kadar gen olduğunu biliyoruz. Bu genlerden üretilen proteinlerin hücrede bulundukları yerler bakımından sınıflandıracak olursak Şekil 7’deki gibi bir tabloyla karşılaşıyoruz (kaynak: proteinatlas.org). Buna göre, toplam gen sayımızın sadece %24’ü hücre yüzeyindeki proteinleri kodluyor. Bu proteinler, antikor tedavileri veya CAR teknolojisiyle hedeflenebilir. Hücreden salgılanan proteinleri kodlayan genler ise toplam gen sayısının %11’ini oluşturuyor ki bunlar da antikor tedavileriyle hedeflenebilir. Birden çok yerde görülen proteinleri de dahil edersek antikor ve CAR tedavileriyle toplamda var olan antijenlerin ancak %39’unu hedefleyebildiğimizi görüyoruz. Problemli olan TCR-T hücreleri hariç, güncel immünoterapi yaklaşımlarında kullanılan uygulamalardan hepsi işte bu %39’luk kısımdaki molekülleri hedefleyerek çalışıyor. Fakat antikorlar veya CAR teknolojisi hücre içindeki proteinlere ulaşamadığı için geri kalan %61’lik kısmı hedefleyemiyoruz. Yukarıda da bahsettiğimiz gibi hücre içi genlerin hedeflenebilmesi için sadece TCR teknolojisi kullanılabiliyor ve bu teknolojinin T hücrelerindeki uygulaması ise yanlış eşleşme sorunu yüzünden verimsiz.
TCR-NK hücreleri çözüm olabilir mi?
Hangi İmmünoloji kitabını açıp bakarsanız şöyle diyecektir: NK hücrelerinde TCR yoktur. MHC moleküllerine KIR (Killer-cell immunoglobulin-like receptor) ismi verilen başka bir reseptörü kullanarak bağlanırlar. KIR moleküllerinin MHC’ye bağlanması TCR’den farklı bir şekilde olduğu için MHC üzerinde sunulan peptitin kimliğini algılayamaz, sadece MHC’nin varlığını veya yokluğunu algılayabilir. T hücreleri ve NK hücrelerinin hedef hücre yüzeyindeki MHC’ye verdiği tepki farklıdır demiştik. İşte Şekil 2’de özetlenen farklı tepkilerin sebebi de bu, NK hücrelerinde TCR olmaması.
T hücrelerinde TCR’nin sinyallerini iletme görevi üstlenen CD3-zeta proteini, normal şartlarda NK hücrelerinde de mevcut ve NK hücresi yüzeyinde bulunan başka reseptörlerle iş birliği içinde çalışıyor. Zaten CAR-NK çalışmalarından da bilindiği gibi CD3-zeta NK hücrelerinin aktivasyonunu tetiklemek için yeterli. Fakat TCR kompleksinin yapısındaki diğer CD3 proteinlerine de ihtiyaç olduğu için T hücrelerine yapılan TCR gen transferi NK hücrelerine yapıldığında çalışmıyor. TCR kompleksi içerisindeki toplam 6 tane farklı genden sadece CD3-zeta geni NK hücrelerinde mevcutken diğer 5 tanesi (TCR-alfa-, TCR-beta, CD3-delta, CD3-gama, CD3-epsilon) mevcut değil.
European Journal of Immunology’de yayınlanan son çalışmamızda TCR gen transferinin NK hücrelerine yapılmasını önerdik. Bu şekilde T hücrelerine yapılan TCR gen transferi sonrası ortaya çıkan yanlış eşleşme probleminin önüne geçebilmeyi ve hücre içi antijenlerin sağlıklı bir şekilde hedeflenebilmesini sağlayabileceğimizi düşünüyorduk.
Gerekli tüm genlerin NK hücrelerine transferinden sonra hücre yüzeyinde fonksiyonel TCR kompleksleri oluşturabildiğimizi ve TCR taşıyan NK hücrelerinin tıpkı T hücresi gibi tümör antijenlerine spesifik olarak cevap verebildiklerini gördük (Şekil 8).
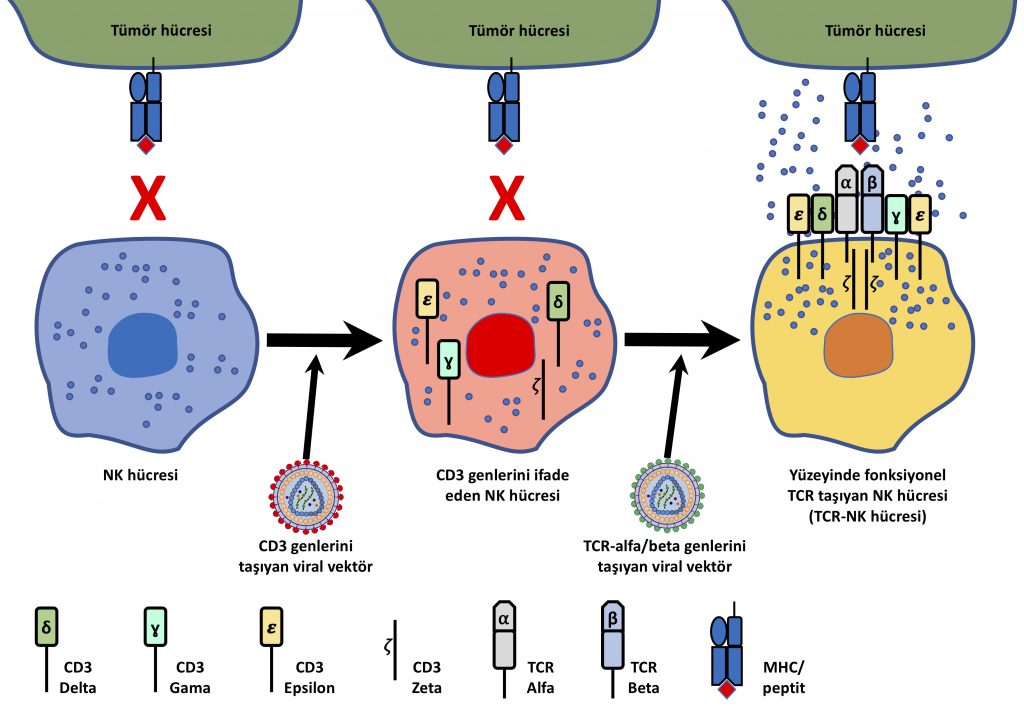
Geliştirdiğimiz TCR-NK hücreleri, T hücrelerindeki gibi bir yanlış eşleşme problemi söz konusu bile olmadan, yani çok daha güvenli bir şekilde hücre içi moleküllerin hedeflenmesini sağlayabiliyor. Buna dair yaptığımız ilk hayvan deneylerinde, bir çeşit cilt kanseri olan melanom tümörlerini taşıyan farelerin bu kansere spesifik olarak hedeflenmiş TCR-NK hücreleriyle verimli bir şekilde tedavi edilebildiğini gözlemledik.
Kanser immünoterapisi, hem hedeflenebilme özelliğinden kaynaklı düşük yan etkileri hem de bağışıklık sisteminin sağlayabildiği uzun süreli koruma sayesinde modern tıp uygulamaları arasında her geçen gün daha çok gündeme gelen bir yaklaşım. 2018 yılında Nobel ödülüne de layık görülen, bağışıklık sisteminin genel tedavilerle topyekün uyarılmasına dayalı yaklaşımlar güncel klinik uygulamalarda başarı kazandıkça tümör antijenlerine yönelik spesifik uygulamaların da tedavi verimini arttırmakta ve yan etkileri azaltmaktaki önemi daha da öne çıkıyor. Geliştirdiğimiz TCR-NK teknolojisi, kanser immünoterapisi alanında hücre içi antijenlerin hedeflenmesine yönelik yeni bir yaklaşım olmakla kalmayıp aynı zamanda TCR-T hücrelerinde görülen yanlış eşleşme sorununun nihai çözümüdür. Bu sayede birçok yeni tedavinin geliştirilmesine zemin sağlayabilecektir.
Sanırım son olarak açıklığa kavuşturmam gereken nokta ise bu tedavinin ne zaman hastalara ulaşabileceği konusu. Son günlerde bu teknolojiyle ilgili basında çıkan haberlerden sonra birçok hasta yakınından bununla ilgili yoğun talepler aldık. Mevcut tedavilerden fayda görememiş ve umutları giderek tükenmekte olan insanlar “son bir umut” diye düşünerek klinik denemeler için gönüllü olma taleplerini dile getirmiş olsalar da çalışmalarımızın gelmiş olduğu noktada bu tedaviyi uygulamak ne teknik olarak mümkündür ne de etik olarak uygundur.
Tüm gerekli bilimsel, teknik ve idari aşamalardan geçip hekimlerin onayını alarak tam anlamıyla hazır olmadan tedaviyi uygulamak hastalara zarar verebileceği gibi bu tüm ekibimizin kariyerinin sonu anlamına da gelecektir ve geliştirmeye çalıştığımız tedavilerden ilerleyen yıllarda fayda görebilecek belki de binlerce hastayı bundan mahrum bırakacaktır. İnsanı çaresiz hissettiren bu hastalık karşısında bir umut olarak gönderdiğiniz bu taleplere olumlu yanıt veremediğimiz için tüm ekip arkadaşlarım adına özür dilerim. İlerleyen deneylerde nelerle karşılaşacağımızı bilmediğimiz için şu andan bir zaman tahmini yapmak oldukça zor ama mevcut gidişat dahilinde 3 seneden önce bu teknolojinin klinik denemeler için hazır olmasının çok zor olduğunu belirtmem gerekir.
Yeni ilaçlar veya immünoterapi yöntemlerini araştıran, klinik denemeler kapsamında uygulanan deneysel tedavileri doktorunuza danışarak veya aşağıda listelediğim şu sitelerinden takip edebilirsiniz:
- https://clinicaltrials.gov/(Amerika)
- https://eudract.ema.europa.eu/(Avrupa)
Belirtmem gerekir ki bu çalışmaların hemen hepsi yurtdışındadır ve çok sınırlı sayıda hasta kabul ederler fakat deneysel tedaviler olduğu için hastalardan ücret talep edilmez.
Tolga Sütlü
Boğaziçi Üniversitesi Moleküler Biyoloji ve Genetik Bölümü öğretim üyesi
[1] T ve NK hücrelerinin öldürme fonksiyonuna sahip olmayan alt grupları da vardır fakat bu yazı kapsamı dışındadırlar
[2] NK hücrelerinin MHC molekülünün hedef hücre yüzeyinden kaybolduğunu nasıl algılayabildiğine dair mekanizmaları başka bir yazıda tartışmak üzere şimdilik atlıyorum
[3] Normal hücrelerin genleri arasında var olmayan bu yeni reseptör dizaynında T hücresi yüzeyinde kalacak kısım için hedef moleküle spesifik bir antikorun tanıma bölgesi kullanılırken hücre içinde kalacak kısmında da CD3-zeta proteinin dizileri kullanılır (Bu iki kısmı birbirine bağlayan aradaki diziler ve CD3-zeta dışında hücre içi kısmında kullanılan dizilerin içeriğine göre farklı CAR reseptörleri tasarlamak mümkündür fakat bu detayları da başka bir yazıda anlatmak üzere söz verip geçelim).