Kanseri tedavi etmek amacıyla bağışıklık sisteminin kullanılmasına dayalı yaklaşımlar kanser immünoterapisi olarak adlandırılıyor. 2018 Nobel Tıp Ödülü, “bağışıklığın negatif düzenlemesinin baskılanmasıyla kanser tedavisi konusundaki keşifleri” için James P. Allison ve Tasuku Honjo’ya verildiğinden beri kanser immünoterapisi kavramını her geçen gün daha fazla duymaya başladık. Peki Allison ve Honjo’nun Nobel’e layık görülen bu keşiflerine temel sağlayan bilimsel gelişmeler nelerdi? Bağışıklık sistemimiz ve tümörler arasındaki ilişkiye dair geçmişten bugüne neler öğrendik? Ve belki de en önemli soru: bağışıklık sistemini kullanarak kanseri tedavi etmek mümkün müdür?
İlk Bulgular

Tarihin en eski çağlarından bu yana çeşitli kaynaklarda kanser ve bağışıklık sistemi arasındaki ilişkiye dair ipuçları bulabiliriz. Örneğin, M.Ö. 2600 yıllarında Mısır’da yaşamış olan hekim Imhotep’e atfedilen kayıtlarda vücut dışına doğru şişkinlik yapan tümörlerin tedavisi için bölgeye bir kesi atılarak enfekte olmaya açık bir yara haline getirilmesi tavsiye edilmiştir. Bu tedavinin ne kadar başarılı olduğunu tam olarak bilemesek de bugün bağışıklık sistemi hakkında bildiklerimizle bu yaklaşıma bakacak olursak, ana fikrin bölgede enfeksiyonun varlığı sayesinde bağışıklık sistemini harekete geçirmek ve enfeksiyonu temizlemek için bu bölgeye saldıran bağışıklık sistemi hücrelerinin arada kanser hücrelerini de öldürmelerini ümit etmek olduğu anlaşılıyor.
Tıp literatüründe nadir de olsa örnekleri karşımıza çıkan bazı durumlarda ise, istemsiz olarak oluşan bir enfeksiyon sonrası harekete geçen bağışıklık sisteminin vücutta var olan bir tümöre saldırarak onu yok edebildiği görülüyor. Dışarıdan bakıldığında tümörün kendi kendine küçülerek yok olması gibi gözlemlenen bu durumlar spontane regresyon (kendi kendine gerileme) olarak adlandırılıyor. Bu gibi gözlemler bilim insanlarını kanser ve bağışıklık sistemi arasındaki ilişkiyi daha detaylı araştırma yoluna sevk etse de elbette farklı çevrelerde doğaüstü yorumları da gündeme getirmiş.

Bunlardan belki en ilginci 1265-1345 yılları arasında yaşamış olan İtalyan rahip Peregrine Laziozi’nin hikayesi. Rivayete göre, rahip Peregrine’in kaval kemiği üzerindeki tümör o kadar büyümüştü ki sonunda bacağının derisi çatlayıp tümör açık bir yara haline gelmişti. Bunu takip eden günlerde, enfekte olan tümör giderek küçüldü ve sonunda tamamen yok oldu. O günlerde bir “mucize” olarak değerlendirilen bu olaydan sonra rahip Peregrine, bugün bile birçok kanser hastasının şifa için dualarını ilettiği “Aziz Peregrine” oluverdi. İmmünoloji biliminin bugün geldiği noktada ise Aziz Peregrine’in tümörünün “kendi kendine” küçülmesinden sorumlu moleküler düzeydeki mekanizmaları çok daha iyi biliyoruz.
Modern Tıpta Kanser İmmünoterapisi
1800’lerin ikinci yarısına geldiğimizde spontane regresyon hikayelerine bilimsel olarak yaklaşan hekimler, tarih sahnesinde ardı ardına yerini almaya başladı. 1868 yılında Alman bilim insanı Wilhelm Busch, tıp literatürüne bir ilk olarak geçecek olan makalesinde, spontane regresyon gözlemlerinden yola çıkarak bilinçli olarak enfekte edilen bir tümörde küçülme gözlemlediğini bildirdi[1].

Benzer bir spontane regresyon hikayesi New York’lu Doktor William B. Coley’in bir hastasının başına geldiğinde ise Coley bu hasta üzerindeki gözlemleri sayesinde bugün immünoterapi olarak adlandırabileceğimiz ilk sistematik tıbbi çalışmaları yaparak bilimsel literatüre sunan kişi oldu. Coley, bir hastasında takip ettiği ve ameliyat etmek için fazla büyük olan bir tümörün enfekte olduğunu ve sonrasında küçülmeye başladığını gözlemlemişti. Bu enfeksiyonla tümör arasında bir ilişki olduğu fikri, onu neredeyse takıntılı bir şekilde tüm 19. Yüzyıl tıp literatürünü detaylı bir şekilde elden geçirmeye ve yayınlanmış 47 ayrı spontane regresyon vakasını tespit etmeye sevk etti. Bu vakalardaki enfeksiyon hikayelerini sistematik bir şekilde analiz ederek bu tip reaksiyonları tetiklemeye en yatkın enfeksiyon çeşitlerinin tespit edilebileceğini düşünen Coley, bakterilerden yaptığı ve Coley’in toksinleri diye adlandırılan karışımları kullanarak kanser tedavisinde elde ettiği (enfeksiyondan kaynaklı yan etkileri görmezden gelirsek) başarılı sonuçları anlatan makalesini 1891 yılında yayınladı[2]. Nobel ödüllerinin hayatta olan bilim insanlarına verilmesi gibi bir kural olmasaydı belki de kanser immünoterapisi alanında verilecek bir Nobel ödülünü esas hak eden kişinin Dr. William B. Coley olduğunu tartışabilirdik.
Aynı yıllardaki bazı keşiflerin, o günlerde kanserle alakalı görünmese de immünoloji bilimi ve kanser immünoterapisi uygulamaları için ileride çok büyük etkileri olacaktı. 1890 yılında Emil von Behring ve Kitasato Shibasaburo bağışıklık sistemindeki antikor adı verilen molekülleri keşfettiler[3]. Emil von Behring ilerleyen yıllarda bu keşfi için Nobel ödülüne layık görüldü. Antikorlar, bağışıklık sistemindeki B hücresi ismi verilen hücreler tarafından üretilen moleküllerdir ve vücuda giren yabancı ajanların tespit edilmesinde kullanılırlar. Her antikor molekülünün spesifik olarak tanıyabildiği bir hedef molekülü (antijen) vardır ve milyonlarca farklı molekülün arasında kalsa bile gidip kendi spesifik hedefini bularak ona bağlanabilir. Mesela vücuda giren bir bakteriye karşı olan spesifik antikorların salgılanmasıyla, bu bakteri hücreleri bağışıklık sistemi tarafından tanınarak yok edilebilir. Antikorların keşfi de esasen vücudun enfeksiyonlara karşı verdiği tepkinin incelenmesiyle mümkün oldu ve aşılama fikrinin arkasında yatan mekanizmayı da açıkladı. Bu bilimsel gelişmeler ışığında bugün biliyoruz ki aşı olarak vücuda verilen öldürülmüş veya zayıflatılmış bakterileri tanıyarak onlara karşı antikor üretmeyi öğrenen bağışıklık sistemi daha sonra aynı enfeksiyonla gerçekten karşılaştığında bu antikorlar sayesinde onun üstesinden kolaylıkla gelebiliyor. Aşıların keşfi sayesinde enfeksiyon hastalıklarının tedavisinde büyük bir yol kat etmiş olan tıp dünyası, antikorların kansere karşı kullanılması fikrinin gelişebilmesi için ise öncelikle bağışıklık sistemi ve kanser arasında bir ilişki olduğuna ikna olmalıydı.
Kanser ve Bağışıklık Sistemi İlişkisi
1900’lerin başından itibaren birçok bilim insanı bağışıklık sistemi ve kanser arasındaki ilişkiye dair giderek detaylanan keşifleriyle bu günkü immünoterapi uygulamalarının önünü açtı. 1908 Yılı Nobel Tıp ödülünü bağışıklık sistemi konusundaki çalışmaları sayesinde Ilya Mechnikov ile paylaşan Alman immünolog Paul Ehrlich, ertesi sene yayınladığı makalesinde “bağışıklık sistemi birçok tümörün büyümesini sınırlandırabilecek kapasiteye sahiptir[4]” demiş olsa da bu yıllarda Ehrlich’in hipotezlerini ispatlayacak bilimsel metotlar halen gelişmemişti. 1959 yılına gelindiğinde ise Lewis Thomas ve Sir Frank MacFarlane Burnet art arda yaptıkları yayınlarla “Kanserin İmmün Gözetimi” (Cancer Immunosurveillance) teorisini kurdular[5],[6],[7].
Bu teoriye göre, vücudumuzda sürekli olarak mikroskobik düzeyde tümörler gelişiyor, fakat bağışıklık sistemimiz bunları yok ediyor. Bağışıklık sisteminin birincil görevi vücudu yabancı ajanlara karşı korumak ama aynı zamanda kanserleşen dokudaki farklılaşmaları ve mutasyonlar sonucu ortaya çıkan değişiklikleri fark ederek saldırabilme yeteneğine de sahip. Birçok durumda bu saldırı başarılı oluyor ve bizim haberimiz bile olmadan kanser hücreleri vücuttan başarılı bir şekilde temizleniyor (Senaryo 1). Mikroskobik düzeyde gelişmekte olan bir tümör ancak ve ancak bağışıklık sisteminin bu saldırısından kurtulmayı başarabilirse büyüyebiliyor ve belirli bir boyuta ulaşıp dokusal bütünlüğü bozmaya başladığında ise bu durum kanser hastalığı olarak teşhis ediliyor (Senaryo 2).
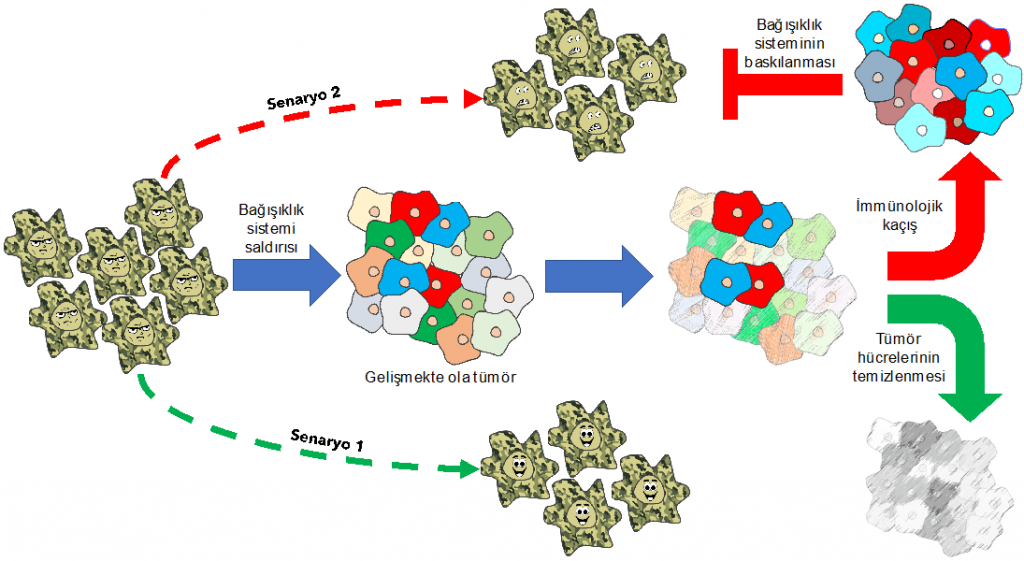
Bu bağlamda, gelişmekte olan tümör üzerinde bağışıklık sistemi baskısıyla oluşan bir mikroevrimden söz edebiliriz. Kanserle ilgili en sık rastlanan yanılgılardan birisi, bir tümörün birbirinin aynısı olan hücrelerden oluştuğunun zannedilmesidir. Esasen, kanser hücreleri kontrolsüz bölündükleri için genlerinde giderek artan sayıda mutasyon barındırırlar. Bu mutasyonlar her bölünme sırasında rastgele oluştuğu için her bir hücrede farklı mutasyonlar birikecektir. Bu da bir tümör içindeki her hücrenin aslında taşıdığı mutasyonlar bakımından birbirinden farklı olması manasına gelir. Bu hücreleri büyük bir popülasyon olarak düşünecek olursak bağışıklık sistemi de bu popülasyon üzerindeki seçilim kuvvetidir. Biriken mutasyonların birçoğu tümör hücreleriyle bağışıklık sisteminin etkileşimini etkilemeyecek olsa da bu rastgele dağılımın içindeki nadir bazı mutasyonlar bağışıklık sistemi saldırılarından kurtulmak için gerekli özellikleri tümör hücrelerine kazandırabilir. Bu durumda bağışıklık sistemi diğer tümör hücrelerini öldürürken bu mutasyonu taşıyan hücreleri öldüremeyebilir. Bu tip mutasyonlara rastlayarak hayatta kalmayı başarabilen az sayıda tümör hücresi bağışıklık sistemi hücrelerinden kaçabilmeyi ve hatta kimi durumlarda bağışıklık sistemini baskılamayı başarabilir. Bu durumda da kanserin gelişmesine şahit oluruz. Tümör büyüdükçe, bağışıklık sistemine karşı daha dirençli olacak hatta hastalığın ileri safhalarında bağışıklık sistemini neredeyse tamamen çökertebilecek düzeyde baskılayacaktır (Senaryo 2).
Peki tümörün bağışıklık sistemini baskılaması ne demek? Elbette tümörlerin bir neden-sonuç ilişkisi içerisinde düşünerek bağışıklık sistemine karşı bilinçli bir saldırıya geçmesinden bahsetmiyoruz. Bu aslında tam olarak bu seneki Nobel Tıp ödülü duyurusunda geçen “negatif bağışıklık düzenlemesi” kavramı ile ilgili. Burada bahsi geçen mekanizmalar, esasen bağışıklık sisteminin kendi kendisini kontrol etmekte kullandığı mekanizmalar. Bunlar immün kontrol noktaları veya fren mekanizmaları olarak da bilinir. İşte 2018 Nobel Tıp Ödülü, bu mekanizmaları keşfederek kanser tedavisinde kullanmayı başarabilen iki bilim insanına verildi.
Kanserin bağışıklık sisteminin frenine bastığı ve bu fren mekanizmalarının ortadan kaldırılmasıyla T hücrelerinin yeniden kanser hücrelerine saldırabileceği hipotezi, kanser tedavisinde yeni bir yaklaşım olarak 1990’larda James P. Allison ve Tasuku Honjo’nun paha biçilmez katkılarıyla ön plana çıktı. Bu iki araştırmacıdan Allison CTLA-4 molekülünü, Honjo ise PD-1 molekülünü bloklayan antikorlar kullanarak önce farelerde, daha sonra ise klinik denemelerde olumlu sonuçlar almış ve bu yeni tedavi yöntemini klinik uygulamaya sokan kişiler olmuşlardır. Bu konuyla ilgili daha fazla detay için 2018 Nobel Tıp Ödülü hakkındaki yazımızı okuyabilirsiniz.
Kanser İmmünoterapisinde Antikorlar
Allison ve Honjo tarafından geliştirilen tedavilerde de kullanılan antikorlar, güncel kanser immünoterapisi uygulamaları arasında en yaygın kullanılan ajanlar olarak ön plana çıkıyorlar. İlk keşiflerinden sonra özellikle enfeksiyon hastalıklarının tedavisinde büyük ilerleme sağlayan antikorlar, kanser ve bağışıklık sistemi arasındaki ilişki su yüzüne çıkmaya başladıkça bu konudaki birçok başarılı araştırmanın ve yeni tedavi yaklaşımlarının da bel kemiğini oluşturdu. Aşağıdaki şekilde gösterildiği gibi antikorlar “Y” harfine benzer şekilde yapısı olan ve bağışıklık sistemi hücrelerinden B hücresi adı verilen bir grup tarafından üretilen protein yapıdaki moleküllerdir. Her antikor üzerinde, spesifik olarak hedefli olduğu antijeni tanıması için iki tane antijen bağlanma bölgesi ve bağışıklık sistemiyle etkileşebilmesi için bir sabit bölge vardır (Şekil 2 A).
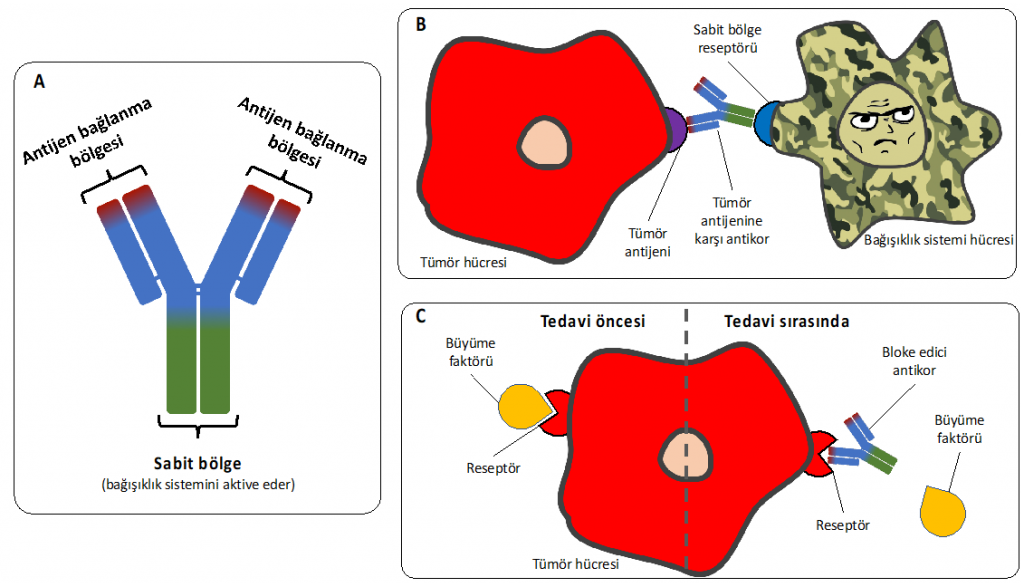
Antikorların birincil görevi hedefli oldukları antijene bağlanarak onu bloke etmek ve/veya bağışıklık sistemini bu antijenin varlığından haberdar etmektir. Bir antikor, antijenine bağlandığı zaman, antikorun diğer ucundaki sabit bölge de bağışıklık sisteminde görevli kompleman moleküllerine veya üzerinde sabit bölge reseptörü bulunan Doğal Öldürücü (NK – Natural Killer) hücrelere ve Makrofaj hücrelerine bağlanıp onları aktive eder. Bu aktivasyon sayesinde bağışıklık sistemi antijeni taşıyan hücreye saldırarak onu yok eder (Şekil 2 B). Bağışıklık sisteminin günlük çalışmasında enfeksiyonlardan korunmak için kullanılan bu yöntem, kansere özgül antijenlerin keşfi ve onlara karşı antikorların geliştirilmesi sayesinde tedavide başarılı bir şekilde kullanılmaya başlandı.
Kanser immünoterapisinde antikorların sık kullanıldığı bir diğer yaklaşım ise kanser hücreleri için önemli olan büyüme faktörlerinin bloklanmasıdır. Mesela meme kanseri tedavisinde büyük başarıyla kullanılan bir antikor, meme kanseri hücrelerinin yüzeyinde bulunan ve kanserin büyümesi için önemli bir reseptör olan HER2 reseptörüne bağlanıp onu bloke edecek şekilde tasarlanmıştır (Şekil 2 C). Bu blokaj sayesinde kanser hücrelerinin çoğalması için gerekli olan büyüme faktörlerinden faydalanmalarının önüne geçilerek tümörün büyümesi başarılı bir şekilde durdurulabilir.
Gelecek Geldi: Hücresel Tedaviler
Antikor tedavileri artık rutin tıp uygulamaları arasındaki yerini alırken, yeni immünoterapi yaklaşımlarının geldiği nokta artık bilim-kurgu hikayelerini aratmıyor. Vücut içinde tümör tarafından baskılanmakta olan bağışıklık sistemi hücrelerini aktif hale getirmenin bir yolu olarak artık bu hücreler vücut dışına alınarak laboratuvarda çoğaltılıp tekrar tümör hücrelerini öldürebilir hale getirilebiliyor. Bağışıklık sistemi hücrelerinin kültür ortamında çoğaltılıp aktive edildikten sonra hastaya geri verilmesine dayalı hücresel tedaviler klinik olarak oldukça olumlu sonuçlar veriyor. Kanserli dokuya saldıracak hücrelerin seçilmesi ve kültürde büyütülmesi son derece umut verici olsa da günümüz teknolojisiyle her hasta için oldukça masraflı ve uzun süreli prosedürlere ihtiyaç duyulan bu yöntem için pek çok hastanın yeterli zamanı ne yazık ki bulunmuyor. Bu tedavi yaklaşımının geniş bir hasta grubuna klinik olarak uygulanabilir olması için, önceden kanser hücrelerine karşı etkisi tespit edilmiş reseptörleri kodlayan genlerin kullanımıyla tümöre saldıracak bağışıklık sistemi hücrelerinin hızlı üretimine yönelik gen transferi çalışmaları ise büyük umutlar vadediyor.
Kültür ortamında genetik olarak değiştirilerek kansere spesifik hale getirilen bağışıklık sistemi hücreleriyle yapılan immünoterapi uygulamalarında kullanılan iki tip hücre mevcut; T hücreleri ve Doğal Öldürücü (NK) hücreler. Bu hücrelerin tümöre yönlendirilebilmesi için genetik modifikasyonda gelinen son nokta ise Kimerik Antijen Reseptörleri (CAR) teknolojisi. Bu yaklaşımların başı çektiği hücresel tedavilerin kanser immünoterapisinde kullanım alanlarını bir sonraki yazıda daha detaylı olarak inceleyeceğiz.
Tolga Sütlü
Sabancı Üniversitesi Nanoteknoloji Araştırma ve Uygulama Merkezi
[1] Busch W. Aus der Sitzung der medicinischen Section vom 13 November 1867. Berlin Klin Wochenschr 1868;5:137.
[2] Coley WB. The treatment of malignant tumors by repeated inoculations of erysipelas. With a report of ten original cases. Am J Medical Sciences 1893;105:487-511
[3] Von Behring E, Kitasato S. Ueber das Zustandekommen der Diphtherie-Immunität und der Tetanus-Immunität bei Thieren. Dtsch Med Wschr 1890;16:1113-4.
[4] Ehrlich P. Über den jetzigen stand der karzinomforschung. Ned Tijdschr Geneeskd. 1909;5:273–290.
[5] Burnet M. Cancer: a biological approach. III. Viruses associated with neoplastic conditions. IV. Practical applications. Br Med J 1957;1:841- 7.
[6] Burnet FM. The concept of immunological surveillance. Prog Exp Tumor Res 1970;13:1-27.
[7] Thomas L. Discussion. In: Lawrence HS, editor. Cellular and Humoral Aspects of the Hypersensitive States. New York, NY: Hoeber-Harper; 1959. p. 529-32.