Covid-19’a karşı geliştirilen aşıları hep birlikte takip ediyoruz. Bu arada inaktive, mRNA, viral vektör gibi birçok aşı tipi duyuyoruz. Bu yazıda mevcut aşı teknolojilerini kısaca anlatacağız.
Aşının içinde hastalık etkenlerinin karakteristik özelliklerini taşıyan, çoğunlukla protein yapısında antijenler bulunur. Kas dokusu içinde yerleşmiş bağışıklık sistemi hücreleri bu antijenlerle karşılaşınca aktive olur ve mesajı bağışıklık sisteminin diğer hücrelerine iletirler. Son tahlilde, bağışıklık sistemi çok basamaklı ve incelikle orkestra edilmiş kompleks bir savunma yanıtı ortaya çıkarır.
Aşılar genellikle kas içine enjeksiyon yöntemi ile uygulanır. Bu yolla, uygulama kolaylığı dışında, aşının doğrudan doku içinde yerleşmiş bağışıklık sistemi ile karşılaşması sağlanır. Doğal enfeksiyon giriş yolunu taklit eden aşı uygulamaları da var. Örneğin gaita-ağız yoluyla bulaşan çocuk felci hastalığında aşı ağız yolundan (oral yol) uygulanabiliyor. Benzer şekilde burundan verilen (intranazal) bir grip aşısı da var.
Aşıdan hemen sonra enjeksiyon yerinde görülen yanma, ağrı, kızarıklık gibi belirtiler, bağışıklık sisteminin gösterdiği ilk tepkiler olarak da kabul edilebilir. Bu tip reaksiyonlar her aşı ile görülmez.
Antijenleri tanıyan bağışıklık sistemi, onları bağlayan ve yok edilmelerini kolaylaştıran antikorları üretir. Protein yapısındaki bu antikorlar hastalığı geçiren ya da aşılanan kişilerde bulunan plazma hücreleri tarafından o hastalığa özgü olarak salgılanırlar. Bağışıklık sistemi antijenle tekrar karşılaştığında bu antikorları yeniden üretebilecek hafızaya sahiptir. Antijenlere bağlanan antikorlar enfeksiyonu yenmek için mücadele eden hücreleri uyararak bu maddelerin ortadan kaldırılmasına aracılık ederler.
Aşı içinde antikor yanıtı oluşturan özgün antijenik madde(ler) dışında bağışıklık sistemini tetikleyerek daha güçlü yanıt alınmasını sağlayacak “adjuvan” adı verilen maddeler ile çözeltinin bozulmaması, içinde başka mikropların ürememesi ve doku içinde dağılarak etki yerine ulaşmasını sağlayacak ek “taşıyıcı” maddeler bulunur.
Aşıların bazılarında virüsün zayıflatılmış veya etkisiz hale getirilmiş hali kullanılırken, bazılarında virüsün tamamı değil yalnız protein altbirimleri kullanılır. Bu protein altbirimlerin laboratuvarda üretildiği rekombinant aşılar da vardır. Genetik aşılarda ise etkin madde olarak, tanınması istenen antijen değil, onun vücutta sentezlenmesine imkân veren anahtar nitelikte maddeler verilir.
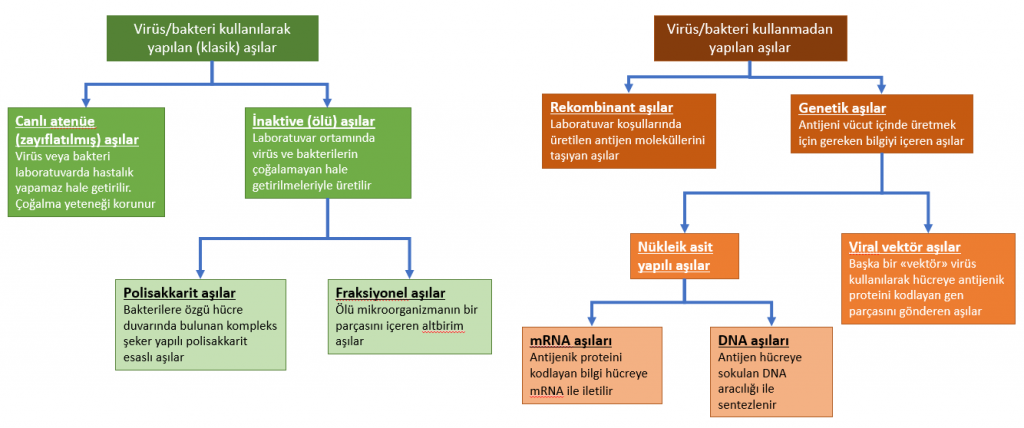
Klasik aşılar 1: Canlı atenüe aşılar
Canlı atenüe aşılar hastalık etkeni olan bakteri ve virüslerin laboratuvar ortamında değiştirilerek zayıflatılmaları esasına dayanır. Aşı içindeki organizma canlılığını muhafaza eder, vücutta çoğalır ve bağışıklık sistemi tarafından etkisiz hale getirilir. Zayıflatıldığı için hastalık yapamaz, aşının istenmeyen etkileri adeta hastalığın “küçük ölçekli bir taklidi” gibidir.
Ağızdan uygulanan atenüe aşılar (çocuk felci aşısı gibi) dışında, enjeksiyonla verilenler genellikle bir uygulamadan sonra yeterli bağışıklık sağlar. Bazen aşı yapılan kişide hali hazırda var olan antikorlar aşı ile verilen virüse bağlanarak onun çoğalmasını engeller. Bu kişilerde yeterli antikor yanıtı oluşmadığı için koruyucu bağışıklık yanıtı gelişmez. Eğer ilk enjeksiyondan sonra yeterli bağışıklık sağlanmamışsa ikinci uygulama yapılır. Bu durumun aksine, aşı eğer bağışıklık sistemi bozuk ya da baskılanmış kişilere uygulanırsa, canlı virüs vücutta aşırı miktarda çoğalarak alıcının ölümüne kadar gidebilecek ciddi istenmeyen reaksiyonlara sebep olabilir.
Canlı atenüe aşı örnekleri:
Viral: Kızamık, kızamıkçık, kabakulak, çiçek, su çiçeği (vaccinia), Varicella zoster (uçuk), rotavirüs, intranazal influenza (grip), sarı humma, adenovirüs
Bakteriyel: Oral tifo, kolera, BCG (verem)
Klasik aşılar 2: İnaktive (ölü) aşılar
- Protein altbirim esaslı fraksiyonel aşılar:
Protein yapılı fraksiyonel aşılar inaktive bakteri toksinleri (toksoid) ya da virüs/virüs altı parçacıklardan saflaştırma yoluyla üretilirler. Covid-19’a karşı bu yolla geliştirilmeye çalışılan geniş bir grup aşı var. Antijenik özellikteki protein altbirimler canlı aşılar ya da inaktive tam virüs aşıları kadar güçlü bir bağışıklık yanıtı oluşturmaz. Hangi altbirim karışımlarının güçlü bağışıklık yanıtı oluşturduğunun saptanması zordur ve deneme gerektirir. Bağışıklık yanıtını güçlendirmek için aşıya adjuvan olarak da adlandırılan bağışıklık sistemini uyarıcı maddeler eklenir. - Bakteriyel polisakkarit esaslı aşılar:
Bakterilere özgü hücre duvarında bulunan polisakkarit (kompleks bir şeker) molekülü de antijen aşı etken maddesi olarak kullanılır. Polisakkarit diğer antijenik maddeler gibi protein yapısında olmadığından, antijenik özelliğini artırmak için bir adjuvanla birleştirilir (konjuge edilir). Polisakkarit aşılar diğer inaktive aşılar gibi tekrarlayan dozlarla antijenik yanıtta artışa sebep olmaz. Bağışıklık sistemi henüz olgunluğa ulaşmamış gençlerde de fazla etkili değildir.
Ölü mikroorganizmalar canlılara göre daha zayıf antijenik özellikte olduklarından yeterli bir bağışıklık sağlamak için birden çok uygulama yapılması gerekir. İlk uygulama koruyucu olmaktan çok bağışıklık sistemini uyararak ikinci ve üçüncü uygulamalara hazır hale getirilmesini amaçlar.
Antikor titreleri (seviyeleri) zamanla azalma eğiliminde olduğundan ölü aşıların belli aralarla tekrarlanması (boosting) gerekir. Bu tip aşılar çoğalmadıkları için bağışıklık sistemi baskılanmış olanlarda bir tehlike oluşturmazlar, atenüe aşıların tersine dolaşımdaki antikorlardan da etkilenmezler.
İnaktive aşı örnekleri
Tüm hücre inaktive aşılar: Polio (çocuk felci), hepatit (sarılık) A, kuduz, Japon ensefaliti
Altbirim aşıları: Hepatit B, influenza (grip), insan papilloma (siğil) virüsü, kabakulak, şarbon
Toksoid aşılar: Difteri, Tetanoz
Saf polisakkarit aşılar: Pnömokok, tifo
Konjuge polisakkarit aşılar: H. influenza tip B, pnömokok, meningokok
Çiçek hastalığının yaygın aşılama ile yeryüzünden silinmesinden bu yana, bir başka yıkıcı hastalık olan çocuk felcinin de tamamen yok edilmesi aşamasına gelmeye yakınız. Çocuk felcinin ortadan kalktığı coğrafyalarda ülkeye her ne şekilde olursa olsun canlı virüs girmemesi için ağızdan canlı atenüe aşı uygulaması tercih edilmez. Ülkemizde de son çocuk felci olgusu 1998’de görüldü. Ancak, Suriye’deki iç savaş nedeniyle artan olguların bize de sıçraması riski var. Bu konuda yaygın bir aşılama kampanyası ve takip programı yürütülüyor. Ancak, savaştan kaçan hedef nüfusun tümüyle aşılandığını söylemek mümkün görünmüyor. Covid-19 pandemisi enfeksiyon hastalıklarına karşı önlemlerin hiç gevşetilmeden sürdürülmesinin önemini gösterdi.
Rekombinant aşılar: Labotuvarda üretilmiş antijenik moleküller
Yeni nesil protein altbirim aşılar rekombinant aşılar olarak da adlandırılır. Genetik rekombinant aşılarda antijenik parçacıklar virüs ya da bakterilerden değil, bu maddeleri adeta bir fabrika gibi üreten biyoteknolojik reaktörlerden oldukça kompleks üretim teknolojileriyle elde edilir. Üretim sırasında başka bakteri ve virüslerle bulaş olmaması için özel önlemler alınır.
Bu teknoloji ilk olarak 1970’li yıllarda insülin üretmek için kullanılmıştı. Sentezi istenen proteinleri kodlayan genler, küf mantarı gibi kültür ortamında üretilebilen hücrelerin genetik materyali içine aktarılarak antijen üretimi gerçekleştirilir. Bu tip üretimleri büyük ölçekte ve güvenilir olarak yapmak güçtür. Bu antijenler bir anlamda fraksiyonel aşılardaki antijenler gibi davranırlar. Protein altbirim aşılar, canlı ya da inaktive aşılara göre daha zayıf bir antikor yanıtı oluşturur çünkü saflaştırılmış proteinlerde, bağışıklık hücrelerini güçlü biçimde tetikleyecek hastalık etkeni ile ilişkili moleküler motifler bulunmaz.
Rekombinant aşı örnekleri
Viral: Hepatit B, bir tip influenza (grip), insan papilloma (siğil) virüsü (HPV), rekombinant zoster virüs (RZV)
Bakteriyel: Meningokok B
Farklı aşılar bir araya getirilerek birden çok hastalığa karşı kombine aşılar üretilebilir.
Antijenik maddeyi üretmek için gereken kodu içeren genetik aşılar
Covid-19 pandemisi aşı geliştirilmesi sürecini hızlandırdı. Salgın haberinin duyulmasının üzerinden bir yıl geçmeden faz 3 klinik araştırmaları belli bir aşamaya gelen ve daha önce hiç denenmemiş iki yeni teknoloji aşı önce Birleşik Krallık ardından da ABD, Kanada ve AB’de acil izin verilerek geniş kitlelerde kullanılmaya başlandı. Peyderpey diğer ülkelerde de kullanıma gireceklerini söylemek bir kehanet değil.
Genetik aşılarda temel mantık rekombinant aşı bölümünde sözü edilen antijenik moleküllerin sentezlenmesi işinin, laboratuvar ortamında hücre kültürü tarafından değil, doğrudan aşılanan kişinin hücreleri tarafından yapılmasıdır. Sentezlenmesi istenen moleküllere ait (1) genetik kodu taşıyan DNA parçası ya da (2) protein sentezini başlatan haberci RNA (mRNA) molekülleri özel yöntemlerle kişinin hücrelerine sokulduktan sonra antijenik olduğu bilinen virüs proteinleri (Sars-Cov2 için en başta geleni “spike” (diken, S) proteinidir) hücre içinde üretilerek antikor yapımını tetikler.
Bu tip aşılar fraksiyonel aşılar gibi birden çok (ilk kullanımda iki) enjeksiyon ile bağışıklık sisteminin giderek artan şekilde uyarılmasını sağlarlar.
Viral vektör aşılar
Vektör, bir etkeni vücuda ya da hücre içine sokabilmek için kullanılan aracı-taşıyıcıyı tanımlar. Viral vektörler gen tedavisi için geliştirilen “platform” tedavi yöntemlerden birisidir. Dolayısıyla pandeminin ortaya çıkmasıyla bu teknolojinin aşıya adapte edilmesi nispeten hızlı olmuştur. Bu tip aşılarda, mesela Sars-Cov2’nin S-proteinini kodlayan gen parçası, enfeksiyon yapmayan başka bir “vektör” virüsün genetik materyaline genetik mühendislik yöntemleriyle eklenir. Vektör virüs hedef hücrelere girdikten sonra, hücrenin protein sentez mekanizmalarını kullanarak S-proteini üretmeye başlar. Sentezlenen “yabancı-antijenik” S-proteinleri hücre zarına yönelerek hücre yüzeyine çıkar ve bağışıklık sistemini uyarır. Bu hücreler artık bir anlamda diğer hücrelerden “yabancılaşmış”, bağışıklık sisteminin hedefi haline gelmiştir. T-lenfositler vektörle enfekte olan hücreleri yok eder, sentezlenen antijenle karşılaşan B-lenfositler ise antikor üretimini uyarır.
Covid-19 aşılarında viral vektör olarak çift zincirli DNA virüs grubundan insan ya da şempanze adenovirüsleri kullanılıyor. Normalde adenovirüsler hafif seyreden üst solunum yolu enfeksiyonuna sebep olurlar. Ancak, vektör olarak kullanılacak adenovirüslerin hücre içinde çoğalma kapasiteleri genetik yapılarıyla oynanarak ortadan kaldırılıyor. Dolayısıyla, etkileri sınırlı ve hastalık yapma potansiyelleri yok. Bu virüs ailesiyle dünya nüfusunun çoğunluğunun daha önceden tanışık olması vektör olarak kullanıldıklarında aşının etkinliğini azaltabilir; şöyle ki, vektör daha iş görmeye başlamadan bağışıklık sistemi tarafından ortadan kaldırılabilir. Bu sorunu giderebilmek için stratejiler geliştiriliyor. Yeni aşıların başarısında bu stratejilerin önemi büyük.
Adenovirüsler dışında kızamık ve suçiçeği virüsleri de vektör olarak kullanılabilir. Covid-19 aşılarında çoğalmayan (replike olmayan) vektörler kullanılmakla birlikte, çoğalan vektörlerle yapılan tedavi girişimleri de var. Bu yeni ileri teknolojilerin gelecekte çok daha geniş kullanım alanlarına sahip olacağı öngörülüyor.
Nükleik asit yapılı aşılar
Nükleik asitler DNA ve RNA, kendi başlarına tedavi ajanı ya da aşı olarak geliştirilebilirler. Covid-19 pandemisi daha önce bir örneği olmayan aşılar için bir test alanı haline geldi. Bu aşıların hızla, düşük maliyetle büyük miktarlarda üretilmeleri mümkün. Ancak, mRNA aşılarının üretildikten sonra özel koşullarda saklanmaları gerekiyor.
Aşının esas etkin maddesi olan mRNA biyolojik reaktörlere ihtiyaç duymadan kimyasal yöntemlerle büyük miktarlarda üretilebilir, DNA üretimi ise bakterilere biyoteknolojik yöntemlerle aktarılan plazmid adı verilen kromozom dışı DNA ekleriyle yapılır. Covid-19 pandemisinde ilk etapta acil kullanım onayı alan mRNA esaslı iki aşı var (Pfizer/Biontech ve Moderna). Hücre içine girişi ve çekirdeğe erişmesi daha zor olan az sayıda DNA esaslı aşı geliştirme çalışması ise henüz faz iki aşamasında.
mRNA aşılar nasıl çalışır?
Haberci (messenger) RNA esaslı aşılarda bağışıklık yanıtının oluşması viral vektör aşılarındaki gibi fakat antijenin hücre tarafından üretilmesi için kullanılan yöntem ve sentezin başlatılma sinyalinin hücreye iletilme şekli farklı.
Protein sentezinin başlatılmasında rol alan haberci mRNA molekülü nanoteknolojik olarak üretilmiş ultra küçük yağ damlacıklarına hapsedilerek hücre içine sokuluyor. Burada genetik şifre yerine şifreyi protein sentez aygıtı “ribozomlara” iletecek olan molekül kullanılıyor. Hücre içine giren mRNA ribozomlara bağlanarak antijenik viral S-proteininin sentezlenmesini sağlanıyor. Bu da diğer aşılarda olduğu gibi antikor üretimini uyarıyor. Bu tip aşılarda hücreye giren malzeme, viral vektöre göre çok daha basitleştirilmiş durumda. Üstelik yukarıda belirtildiği gibi kimyasal yolla çok hızlı ve büyük miktarlarda üretilebiliyor. Moderna aşısının ilk sentezinden sadece iki ay sonra insanda denemelere başlanabilmesi bu durumun en çarpıcı örneklerinden.
Ancak, mRNA aşıları çok narin moleküler yapılar olduğundan ve kolayca bozulabildiğinden, özel depolama koşulları gerekiyor. Bunlardan Pfizer-BioNTech aşısı -70 °C, Moderna ise -20 °C’de saklanmak durumunda. Özel saklama koşulları aşıya erişimde de önemli lojistik sorunlar yaratıyor, toplumsal ve ekonomik eşitsizlikleri artırıyor.
Aşı geliştirme aşamalarını anlatan yazımız için tıklayınız.
Hakan S. Orer
Bilim Akademisi üyesi
Koç Üniversitesi Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı
 Bu eser Creative Commons Atıf-GayriTicari 4.0 Uluslararası Lisansı ile lisanslanmıştır. İçerik kullanım koşulları için tıklayınız.
Bu eser Creative Commons Atıf-GayriTicari 4.0 Uluslararası Lisansı ile lisanslanmıştır. İçerik kullanım koşulları için tıklayınız.