Şekil 1. Cryo-elektron mikroskobuyla oluşturulmuş alkol oksidaz enzimi imajı (Vonck J, Parcej D, Mills D, 2016, Wikimedia Commons).
Maddenin atom seviyesindeki yapısı ve özellikleri ile işlevleri arasında kuvvetli bir bağlantı (korelasyon) bulunur. Bu yüzden bilim insanları maddenin atomlarını ve onların düzenini görüntülemek için onlarca yıldır inanılmaz bir çaba içindeler.
Çünkü görmek inanmaktır. Bunu da sağlayacak en önemli aletlerden birisi elektron mikroskobu. Elektron mikroskobunda optik mikroskobun aksine görünür ışık yerine çok daha küçük dalga boyuna sahip elektronlar görüntüleme için kullanılıyor. Bir mikroskobun çözünürlüğü de kullanılan “ışığın” dalgaboyuna orantılıdır. Dolayısıyla bilim insanları bir elektron mikroskobu ile maddeyi bir araya getiren atomları görüntüleyebiliyorlar. Bu güçlü mikroskobun ve tekniğin geliştirilmesine ilk Nobel Ödülü 1986 yılında Ernst Ruska’ya verilen fizik Nobel’i idi Her ne kadar birçok inorganik maddenin atom seviyesinde görüntülenmesi rutin olarak yapılabilmekte ise de, hayata imkan veren organik moleküllerin yüksek çözünürlüklü yapıları, Jacques Dubochet, Joachim Frank ve Richard Henderson’un birbirini tamamlayan çalışmalarından önce mümkün değildi. Bu yüzden 2017 yılı Kimya Nobel ödülü bu üç bilim insanına cyro-elektron mikroskobunun geliştirilmesi ve böylece biyolojik moleküllerin atom seviyesindeki görüntülenmesindeki çalışmalarından dolayı layık görüldü.
Biyolojik büyük (makro) moleküllerin hayatsal bir çok reaksiyonda önemli rol oynadığı 1950li yıllardan itibaren biliniyordu. Hatta X-ışını kırınımı deneyleriyle simetrik ve kristallesebilen biyomoleküllerin genel bükümlü ve spiral şekli hakkında ilk bulgular elde edilmeye başlanmıştı. 1980li yıllarda da NMR (Nükleer Manyetik Rezonans) ölçümleri sayesinde nispeten küçük biyomoleküllerin atom seviyesindeki yapıları çözülmeye başlandı.
Ancak X-ışını deneyleriyle genelde kristalleşebilen biyomoleküller incelenebiliyor ve NMR ile ise sadece küçük moleküller analiz edilebiliyordu. 2017 Kimya Nobel ödülü sahibi Richard Henderson’a göre çözüm elektron mikroskobuydu. Ancak Henderson’un öğrencilik yıllarında “biyomoleküller elektron mikroskobu için uygun değiller” kanaati hakimdi. Biyomoleküller güçlü elektron hüzmesi altında bozunuyordu. Ayrıca elektron mikroskopları vakum altında çalıştıklarından ilk önce kurutulmaları gerekiyordu, aksi takdirde molekülleri çevreleyen su vakum altında hemen buharlaşıyordu. Bu kurutma sırasında da biyomoleküller doğal ortamlarındaki şekillerini koruyamıyorlar ve çöküyorlardı. Halbuki biyomoleküllerin ve özellikle protein gibi büyük (makro) moleküllerin işlevleri doğrudan 3 boyutlu yapılarıyla bağlantılıdır (Şekil 1)
Dolayısıyla bu moleküllerin doğal ortamlarında ve şekillerinde görüntülenmesi gerekir. Henderson buharlaşma sorununu aşabileceğini, fotosentez yapan bacteriorhodopsin proteinin kendi membranı (zarı) içinde glikoz çözeltisi ile kaplanmış olarak mikroskopta incelediğinde fark etti. Bu protein çok düşük dozlardaki elektron hüzmesi altında uzun süre bozunmadan durabiliyordu. Çözünürlük henüz atom seviyesinde değildi fakat aynı tip protein moleküllerini farklı açılardan görüntüleyerek ve daha sonra bu 2 boyutlu görüntüleri birleştirerek proteinlerin 3 boyutlu dalgalı görüntülerini oluşturdular. Çözünürlük henüz 7 Angstrom ( 0.0000007 milimetre) seviyesindeydi ve atomların moleküldeki yerlerini görmek için yeterli değildi (Şekil 2).
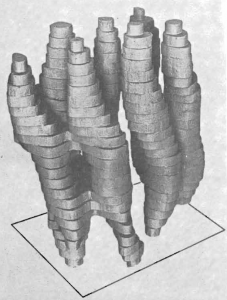
Henderson’un yıllar süren ve dünyanın farklı yerlerindeki elektron mikroskoplarını kullanarak yaptığı çalışmalar 15 yıl sonra sonuç verdi ve X-ışını ile elde edilebilen çözünürlükte 3-boyutlu protein yapısını 1990 yılında yüzlerce 2 boyutlu görüntüyü inceleyip birleştirerek ortaya koydu (Şekil 3)

Bacteriorhodopsin özel bir proteindi ve doğal yapısını glikoz çözeltisi ile kaplandığı zaman elektron mikroskobunun vakum ortamında koruyabiliyordu. Tekniğin diğer biyomoleküllere uygulanabilmesi ise 2017 Kimya Nobel ödülü diğer sahibi Jacques Dubochet’in numune hazırlamadaki çalışmaları sayesinde mümkün oldu. Jacques Dubochet, biyomoleküllerin elektron mikroskobuyla, doğal ortamlarındaki hallerinde izlenebilmeleri için dondurulmaları gerektiğini ve bunu yaparken de suyun kristallenmeden buz (vitrifiye buz) haline geçmesi gerektiğini biliyordu. Etanı sıvı azot kullanarak soğuttuğu cryo-metot ile suyu amorf (düzensiz yapıda) katılaştırmayı başardı. Bu vitrifiye katı haldeki su -160oC altında kaldığı sürece, buz kristallerinin aksine son derece düşük kontrastlı ve monoton bir arkafon oluşturuyor ve biyomoleküllerin (katılaşmış) su içindeki yapılarının görüntülenmesine izin veriyordu. Su o kadar hızla katılaşıyordu ki biyomolekülleri fonksiyonlarının farklı aşamalarında dondurmak mümkün oluyordu. Dubochet’in tekniği kısa sürede biyoloji alanında ve elektron mikroskobu ile çalışan bilim insanı tarafından kullanılmaya başladı. Henderson bunlardan biriydi.
Bulmacanın son halkası, 2017 Kimya Nobel ödülünün üçüncü sahibi tarafından çözüldü. Joachim Frank geliştirdiği matematiksel algoritma ile elektron mikroskobunda elde edilen nesnenin 2 boyutlu izdüşüm imajlarından ilk önce benzerlikleri kullanarak daha net bir görüntü yaratıyor daha sonra bu algoritma, numune tutucunun üzerinde farklı açılarda oturan benzer birçok proteinin resimlerinden molekülün 3 boyutlu şeklini başarıyla ortaya çıkarıyordu. Bu sayede periyodik yapısı olmayan biyomoleküllerin de angström boyutunda atom yapısının tayinine imkan veriyordu.
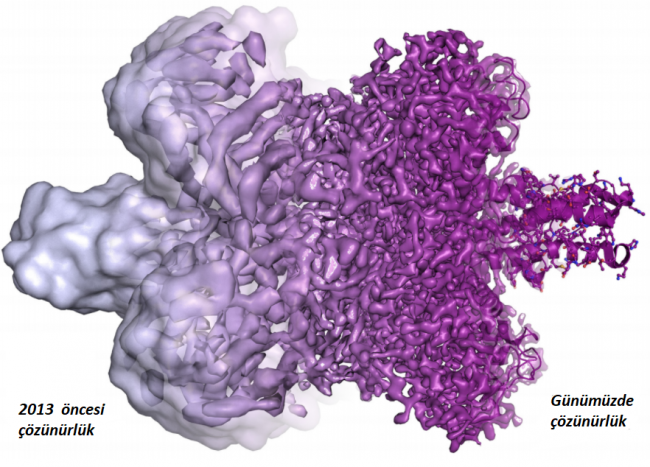
Dubochet’in geliştirdiği dondurma tekniği sayesinde dağınık yapılı biyomoleküller sulu doğal ortamlarında korunabiliyor ve kuvvetli elektron hüzmesi altında incelenebiliyor, Henderson’un kullandığı gelişmiş elektron görüntüleme teknikleri sayesinde moleküllerin iki boyutlu izdüşümleri atom seviyesinde bir çözünürlükle elde edilebiliyor ve Frank’in algoritmaları sayesinde yüksek çözünürlüklü 2 boyutlu resimlerden moleküllerin 3 boyutlu şekilleri oluşturulabiliyor. Bu Nobel ödüllü üç bilim insanı ve ekiplerinin çalışması sonucu artık biyomoleküllerin atom seviyesindeki yapıları ile fonksiyonları arasındaki bağlantı kurulmaya başlandı.
Mehmet Ali Gülgün
Sabancı Üniversitesi, Malzeme Bilimi ve Nanomühendislik Programı öğretim üyesi
_________________
Kaynaklar:
Henderson 1975: Henderson R, P.N. Unwin, Three-dimensional model of purple membrane obtained by electron microscopy, Nature, 257, 28-32, Eylül 1975.
Henderson 1990: Henderson, R., J.M. Baldwin, T.A. Ceska, F. Zemlin, E. Beckmann, K.H. Downing, “Model for the structure of bacteriorhodopsin based on high-resolution electron cryo-microscopy”, 213, Issue 4, pp. 899-929, Haziran 1990
The Nobel Prize in Physics 2017 – Popular Information: They captured life in atomic detail. Nobelprize.org. Nobel Media AB 2014.