Her yıl olduğu gibi bu yıl da Ekim ayının ilk pazartesi günü Fizyoloji veya Tıp alanında Nobel ödülüne hak kazananlar açıklandı. 2021 ödülü duyu sistemindeki moleküler mekanizmaları açıklayan çalışmaları nedeniyle iki Amerikalı bilim insanına verildi. David Julius özellikle sıcaklık duyularının hücrelerde nasıl etki doğurduğunu göstererek ödüle hak kazandı. Ardem Patapoutian ise mekanik (dokunma) duyusunun hücrelere nasıl etki ettiğini göstererek ödülü Julius ile paylaştı.[1]Scientific background: Discoveries of receptors for temperature and touch, The Nobel Prize in Physiology or Medicine 2021 – Advanced information – NobelPrize.org, https://www.nobelprize.org/prizes/medicine/2021/advanced-information/
New York doğumlu olan Julius, Kaliforniya Üniversitesi San Francisco’da Fizyoloji Bölümünde öğretim üyesi. Beyrut doğumlu bir Ermeni olan Ardem Patapoutian 18 yaşında ABD’ye göç etmiş, halen Kaliforniya’da La Jolla Scripps Araştırma Enstitüsünde çalışmalarına devam ediyor.
Canlıların çevreleriyle etkileşimi
Tüm canlılar yaşamlarını sürdürebilmek için çevreleriyle ilişki kurmak, çevreden gelen uyaranları algılamak ve bunlara karşı reaksiyonlar oluşturmak zorunda. Tek hücreli canlılardan başlayarak bitkiler ve tüm hayvanlar dışardan gelen sıcaklık, dokunma, kimyasal uyarılara karşı algılama yöntemleri geliştirmişler. Hayvanlar aleminde görme, işitme, koku alma, tat alma duyuları genellikle gözler, kulaklar, burun, dil gibi özel anatomik bölgelerde algılanıyor. Bununla birlikte dokunma duyusu vücudumuzu saran deri dokusunun her bölgesinde algılanabiliyor.
Dış dünyayı tanımada gerekli olan bu duyuların yanında vücudumuzun iç yapısını algılamamızı sağlayan duyular da var: örneğin görme olmadan da vücudumuzun hangi pozisyonda olduğunu algılayabiliyoruz, organlarımızı hareket ettirebiliyoruz (bilinçsiz derin duyu – propriyosepsiyon). Bugün vücudumuzun hemen her bölgesinde sıcaklık, gerilme, titreşme, acı ve ağrı gibi uyaranlara duyarlı özel hücrelerimiz bulunduğunu biliyoruz. Julius ve Patapoutian’ın çalışmaları bu özel hücrelerin hangi mekanizmalarla uyarıldığı konusunda önemli yeni bilgiler getiriyor.
Deri dokusunda değişik dış uyaranlara duyarlı reseptörler bulunuyor. Aşağıdaki tabloda bu reseptörlerin seçici olarak duyarlılıkları özetleniyor:
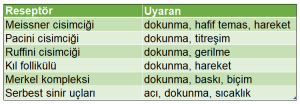
Vücudumuzun her bölgesinde bulunan derideki bu dış etkenlere duyarlı reseptörler Şekil 1’de şematik olarak gösteriliyor.
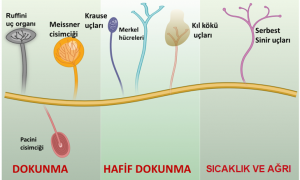
Deride bu reseptörlerin varlığı uzun yıllardan beri bilinmekle birlikte bunların nasıl aktive oldukları ve sinir sistemine iletilmek üzere nasıl bir moleküler değişime neden oldukları bilinmiyordu. Julius ve Patapoutian’ın çalışmaları dış etkenlerin hücrelerle nasıl etkileştikleri konusunu açıklayarak bu yönde çok önemli bir gelişme sağladı.
Acı yeme ateş basar
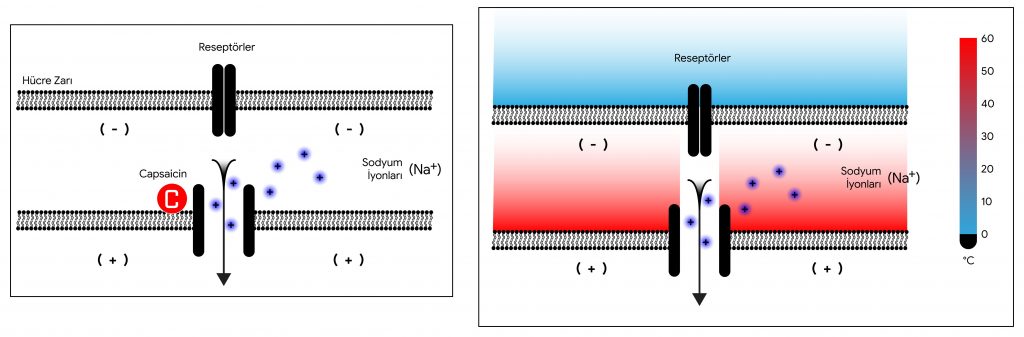
Julius çalışmasına başlangıç olarak acı Meksika biberlerinde bulunan capsaicin maddesinin duyarlı hücreleri nasıl etkilediğini açıklamak üzere başladı. Acı yiyeceklerin aynı zamanda sıcaklık hissi vermesini gözlemleyerek capsaicin’in hücrelerde aynı zamanda sıcaklık reseptörlerini de etkileyeceğini düşündü. Bu görüşten yola çıkarak hücre yüzeyinde özel reseptör proteinlerin varlığını gösterdi. Bu reseptörler capsaicin ile bağlandığında açılarak hücreye sodyum iyonlarının akışını arttırıyor, bu da hücre içi ve dışında bir potansiyel farkı (aksiyon potansiyeli) oluşturarak sinirlere aktarılan bir uyarıya dönüşüyordu. Daha sonraki çalışmalarda nane (mentol) ile soğukluk hissini algılayan reseptörlerin de olduğu anlaşıldı. Ek olarak sarımsak, tarçın gibi keskin tatları tanıyan farklı bir reseptörün de varlığı bulundu.
Bugün için duyarlı hücrelerin yüzeyinde bulunan sıcaklık ve kimyasal etkenlere yanıt veren protein reseptörlerin bir listesi Tablo 2’de gösteriliyor.[2]Caterina, M.J., M.A. Schumacher, M. Tominaga, T.A. Rosen, J.D. Levine, and D. Julius, The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature, 1997. 389(6653): p. 816-24.[3]Voets, T., Talavera, K., Owsianik, G. ve Nilius, B. (2005) Sensing with TRP channels. Nat Chem Biol. 1(2): p. 85-92.

Duyarlı hücrelerin bu şekilde uyarılmaları sonucu oluşan aksiyon potansiyelleri, elektriksel bir akıma dönüşerek sinir lifleriyle merkezi sinir sistemine iletiliyor ve beyinde de ilgili merkezlerde işlenerek duyular olarak algılanıyor. Aşağıda uygun uyaranlara yanıt olarak hücre zarındaki kanalların açılması ile sodyum iyonlarının hücre içine girmesi şematik olarak gösteriliyor (Şekil 2).
Sıcaklık ve acı duyusuna yanıt veren TRPV1 reseptörünün ayrıntılı moleküler yapısı ise Şekil 3’te gösteriliyor.
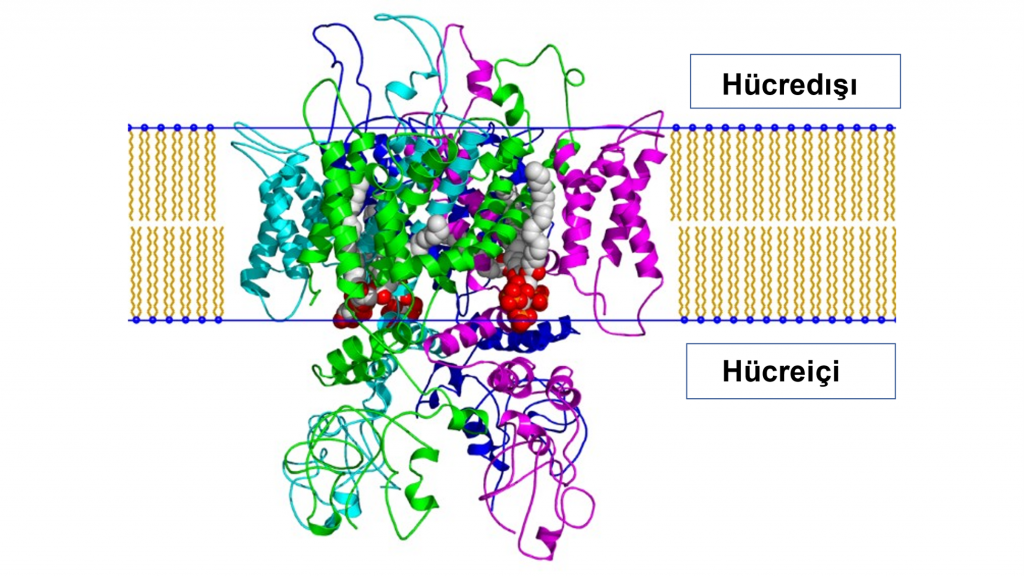
Dokunmanın Mekanizmaları
Kaliforniya, La Jolla’daki Scripps Araştırma Enstitüsünde moleküler biyolog olan Dr. Patapoutian, küçük bir pipetle tek tek hücrelere basınç uygulayarak, basınca, dokunmaya ve vücut parçalarının konumlandırılmasına (bilinçsiz derin duyu-propriyosepsiyon) tepki veren bir reseptörü keşfetti. PIEZO1 olarak adlandırılan bu reseptör, ismini Yunanca basınç kelimesinden alıyor; PIEZO2 adı verilen ikinci bir reseptörün de insanların dokunmayı hissetmesinde rolü olduğu gösterildi.
Patapoutian ve arkadaşları bu kanalların keşfi için akıllıca bir yaklaşım sergilediler. Dokunmaya duyarlı bir hücredeki genleri, hücre yanıt verme yeteneğini kaybedene kadar tek tek susturduktan yani genleri etkisiz hale getirdikten sonra PIEZO1 ve PIEZO2 adlı iki proteinin fiziksel uyarıya verilen yanıtlara aracılık ettiğini doğruladılar, daha sonra, PIEZO proteinlerinin dokunma için kritik olduğunu gösterdiler. İlerleyen çalışmalar Piezo’nun propriyosepsiyon olarak bilinen vücut pozisyonu ve hareketinin bilinçdışı algılanmasında da kilit bir rol oynadığını gösterdi. Ayrıca, PIEZO reseptörleri basınç ve gerilme duyularını algılamak üzere, mesane, gastrointestinal kanal, solunum yolları, kan damarları hatta kırmızı kan hücrelerinde bile saptandı.
PIEZO’lar mekanik sensör olarak iç organlarımızda ne yapar?
PIEZO kanallarının kan basıncı, solunum ve idrar kesesi kontrolü gibi önemli birçok fizyolojik süreci düzenlediği gösterildi.[4]Ranade, S.S., Syeda, R. ve Patapoutian, A. (2015) Mechanically Activated Ion Channels. Neuron, 87(6): p. 1162-1179.[5]Kefauver, J.M., Ward, A.B. ve Patapoutian, A. Discoveries in structure and physiology of mechanically activated ion channels. Nature, 2020. 587(7835): p. 567-576.
Patapoutian laboratuvarı, diğer araştırma gruplarıyla birlikte, akciğerdeki bronş ve bronşiyol duvarındaki gerilme reseptörlerinde bulunan PIEZO2 kanallarının derin nefes almalarla aktive edildiğini ve akciğeri aşırı şişmeden koruyan bir refleks başlattığını gösterdi. Ayrıca, genetik mutasyon çalışmalarıyla, PIEZO2’den yoksun farelerin doğumda solunum sıkıntısı nedeniyle öldüğü bulundu.
Patapoutian ve çalışma arkadaşları kan basıncını sürekli olarak izleyip koruyan arteriyel barorefleks sisteminin hem PIEZO1 hem de PIEZO2 aracılı çalıştığını gösterdi. PIEZO1 ve PIEZO2’den yoksun farelerde labil hipertansiyon (bir kişinin kan basıncı tekrar tekrar veya aniden normalden anormal derecede yüksek seviyelere değişmesi) geliştiği, barorefleks yetmezliği olan insanlarda bulguya benzer şekilde kan basıncı değişkenliğinin arttığı görüldü.
PIEZO2 gastrointestinal sistemde de önemli; mekanik stimülasyona yanıt olarak hormon ve parakrin sinyal moleküllerinin serbest bırakıldığı tespit edildi. Ayrıca, PIEZO2’nin idrar yollarını döşeyen ürotelyal hücrelerdeki ve mesane duyu nöronlarındaki mekanosensör olduğu bulundu. Fonksiyonel PIEZO2’den yoksun insan ve farelerde idrar kesesi kontrolünün bozulduğu gösterildi.
PIEZO1, kan damarlarını döşeyen endotel hücrelerinde, kırmızı kan hücrelerinde ve kemik yapıcı osteoblastlarda mekanik kuvvetlerin sensörü olarak da önemli bir rol oynuyor. Endotel hücrelerinde kayma stresinin algılanması, gelişim sırasında kan damarlarının oluşumu, yetişkin dokularında yeni damar oluşumu (anjiyogenez) ve damar tonusunun düzenlenmesi için önemli. PIEZO1, kırmızı kan hücrelerinin hücre hacmini kontrol ediyor. Farelerde PIEZO1’in silinmesi, kırmızı kan hücrelerinin aşırı şişmesine yol açarken, PIEZO1’i aktive eden Yoda1 adlı kimyasal bir bileşik, kırmızı kan hücrelerinin büzüşmesine neden oluyor.
Kaslardan kaynaklanan mekanik kuvvetler tarafından uyarılan gerilim, iskeletin yeniden şekillenmesiyle bağlantılı ve farelerde mekanik yüke bağlı kemik oluşumu osteoblastlardaki PIEZO1’e dayanıyor.
Çalışmaların önemi ve gelecek
Julius ve Patapoutian’ın çalışmaları canlıların çevreleriyle nasıl etkileştiklerine dair çok önemli bilgiler getiriyor. Bu buluşların insan hastalıklarını anlama ve yeni tedaviler geliştirme yönünde nasıl fayda sağlayacakları ise ileriki yıllarda daha iyi anlaşılacak. Ancak şimdiden sıcaklık duyarlılığı ve acı duyusu ile ilgili çeşitli insan hastalıkları tanımlandı ve bunların TRPV reseptörlerindeki mutasyonlarla ilgisi saptandı. Bu reseptörleri etkileyecek ilaçların geliştirilmesiyle kronik ağrı sendromlarının tedavisine yönelik çalışmalar ise sürüyor. Dokunma ve basınç reseptörlerinin sadece deride değil iç organlarımızda da çok önemli işlevler yaptığı da bu araştırmalar sonucu ortaya çıktı. Kısaca mesanenin veya sindirim organlarının gerilmesi ile doluluk ve boşaltım ihtiyaçlarının algılanması, solunum kanallarının genişlemesi ile nefes almanın düzenlenmesi, eklem ve kaslardaki gerilmelerin belirlenmesiyle bilinçsiz derin duyu (propriyosepsiyon) sisteminin çalışması hatta kan damarlarının genişlemesi ile kan basıncı ve hipertansiyon ilişkisinin açıklanması ve tedavisine yönelik daha akılcı yöntemler bulunması da yeni araştırmalara yol açacak gibi görünüyor. Son yıllarda mekanik duyu reseptörlerinin diğer bazı reseptörlerle birlikte kanser hücrelerinin yayılması ve metastaz yapabilme özelliklerinde de rolü olduğuna yönelik bulgular saptandı.[6]Kärki, T., & Tojkander, S. (2021). TRPV Protein Family—From Mechanosensing to Cancer Invasion. In Biomolecules (Vol. 11, Issue 7, p. 1019). MDPI AG. https://doi.org/10.3390/biom11071019
Bu yıl sıcaklık ve dokunma duyularına verilen Nobel ödülüyle birlikte geçmiş yıllarda da canlıların çevreyle etkileşimini sağlayan duyu sistemleri konusunda verilmiş olan ödülleri anımsamak yararlı olabilir. 1961’de Georg von Békésy seslerin iç kulakta nasıl işitme sinyallerine dönüşerek beyine aktarıldığını gösterip Nobel ödülüne hak kazanmıştı.[7]The Nobel Prize in Physiology or Medicine 1961, https://www.nobelprize.org/prizes/medicine/1961/summary/ 1967’de Ragnar Granit, Haldan Keffer Hartline ve George Wald gözde ışık uyaranlarının elektriksel sinyallere dönüşümünü açıklayan fizyolojik bulgularıyla ödüle ulaşmışlardı.[8]The Nobel Prize in Physiology or Medicine 1967, https://www.nobelprize.org/prizes/medicine/1967/summary/ 2004’de Richard Axel ve Linda B. Buck koku reseptörleri ve koku fizyolojisi alanındaki çalışmalarıyla ödüllendirilmişlerdi.[9]The Nobel Prize in Physiology or Medicine 2004, https://www.nobelprize.org/prizes/medicine/2004/summary/ Julius ve Patapoutian’ın kazandıkları bu son ödülle de, tat alma fizyolojisi dışında, canlıların çevreleriyle olan iletişiminin temel mekanizmalarını inceleyen bilim insanlarına verilen ödüller tamamlanmış oluyor.
Özlem Yalçın (Koç Üniversitesi Tıp Fakültesi, Fizyoloji Anabilim Dalı)
Şevket Ruacan (Bilim Akademisi üyesi, Hacettepe Üniversitesi Tıp Fakültesi, emekli öğretim üyesi)
 Bu eser Creative Commons Atıf-GayriTicari 4.0 Uluslararası Lisansı ile lisanslanmıştır. İçerik kullanım koşulları için tıklayınız.
Bu eser Creative Commons Atıf-GayriTicari 4.0 Uluslararası Lisansı ile lisanslanmıştır. İçerik kullanım koşulları için tıklayınız.
Notlar/Kaynaklar
| ↑1 | Scientific background: Discoveries of receptors for temperature and touch, The Nobel Prize in Physiology or Medicine 2021 – Advanced information – NobelPrize.org, https://www.nobelprize.org/prizes/medicine/2021/advanced-information/ |
|---|---|
| ↑2 | Caterina, M.J., M.A. Schumacher, M. Tominaga, T.A. Rosen, J.D. Levine, and D. Julius, The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature, 1997. 389(6653): p. 816-24. |
| ↑3 | Voets, T., Talavera, K., Owsianik, G. ve Nilius, B. (2005) Sensing with TRP channels. Nat Chem Biol. 1(2): p. 85-92. |
| ↑4 | Ranade, S.S., Syeda, R. ve Patapoutian, A. (2015) Mechanically Activated Ion Channels. Neuron, 87(6): p. 1162-1179. |
| ↑5 | Kefauver, J.M., Ward, A.B. ve Patapoutian, A. Discoveries in structure and physiology of mechanically activated ion channels. Nature, 2020. 587(7835): p. 567-576. |
| ↑6 | Kärki, T., & Tojkander, S. (2021). TRPV Protein Family—From Mechanosensing to Cancer Invasion. In Biomolecules (Vol. 11, Issue 7, p. 1019). MDPI AG. https://doi.org/10.3390/biom11071019 |
| ↑7 | The Nobel Prize in Physiology or Medicine 1961, https://www.nobelprize.org/prizes/medicine/1961/summary/ |
| ↑8 | The Nobel Prize in Physiology or Medicine 1967, https://www.nobelprize.org/prizes/medicine/1967/summary/ |
| ↑9 | The Nobel Prize in Physiology or Medicine 2004, https://www.nobelprize.org/prizes/medicine/2004/summary/ |