Koronavirüs pandemisi hızını artırarak yayılmaya devam ederken dünya kamuoyu aşı geliştirilmesine ilişkin haberlere dikkat kesilmiş, pandemiyi bitirecek aşının bir an önce kullanıma girmesini bekliyor. Gerek hükümetler gerekse ilaç endüstrisi geniş kitleleri hasta olmaktan koruyacak aşının bir an önce bulunması ve kullanıma sunulması için seferber olmuş durumda.
Ancak, geçmiş deneyimler bize aşı geliştirme ve üretiminde olağan dışı hızlandırmaların faydadan çok zarar verebileceğini gösteriyor. Aceleyle kullanıma giren aşıların etkili olmaması ya da önemli istenmeyen etkiler nedeniyle piyasadan çekilmesi salgının kontrol altına alınamaması yanında kamuoyunun aşılara ve sağlık sistemine güvenini sarsabilir ve diğer aşı geliştirme çabalarını da etkileyebilir.
İlaçlar yüksek katma değeri olan bilgiye dayalı ileri teknoloji ürünleridir. Teknik olarak aşı, ilaç kategorisinde bir üründür ancak, klasik anlamda ilaçtan farkı tedavi edici değil, koruyucu olmasıdır. İlaçlar da bazı durumlarda hastalıkları önlemek amacıyla kullanılabilirler. Her ne kadar yeni geliştirilen bazı teknolojiler aşı-ilaç farkını daha belirsizleştirmiş olsa da aşıların ayırıcı karakteri etkilerini bağışıklık sistemini harekete geçirerek göstermeleridir.
Yeni ilaç geliştirilmesi Dünya’da büyük ölçüde özel sektörün öz kaynakları ile gerçekleştirdiği ticari nitelikte rekabetçi bir ekonomik faaliyettir. Günümüzde bir ilacın geliştirilme maliyeti 2 milyar ABD Doları civarına ulaşıyor. Yeni ilaç ve aşılar ilk başvuruyu takiben sınırlı bir süre için fikri mülkiyet hakları koruması altına girer, bu sırada üretici firma bir anlamda tekel haline gelir. Bu şekilde ilacı geliştiren firmaya geliştirilme maliyetini karşılayabileceği ve kazanç sağlayabileceği bir fırsat tanınır.
Ancak, sağlık diğer ekonomik faaliyet alanlarından farklı olarak ikame edilemez. Toplum sağlığının korunmasında büyük önemi olan aşılama programları, ülkelerin temel sağlık politikaları içinde yer alır ve bu niteliğiyle bir yanda ticari kazanç diğer yanda toplumsal fayda arasında bir dengenin kurulması şarttır. Salgın ya da içinde bulunduğumuz pandemi gibi tüm Dünyayı etkileyen daha büyük çapta acil durumlar ortaya çıktığında, araştırmacılar, ilaç endüstrisi, hükümetler ve halk arasında çıkar çatışmaları yaratacak ve ilaç geliştirme sürecini doğrudan etkileyecek birçok durum ortaya çıkabilir. Bunlar da ayrı ayrı değerlendirilmelidir.
Örneğin, ABD Yönetiminin aşı çalışmalarını hızlandırmak ve seçim ayı olan Kasım’dan önce aşının kullanıma girmesi sağlamak için ilaç sanayisine büyük miktarlarda fon aktarırken Dünya Sağlık Örgütü (DSÖ)’nden çıkarak uluslararası dayanışmayı zayıflatıcı kararlar alması ulusal ve uluslararası düzeyde önemli etkiler oluşturabilecek nitelikte [1].
Geniş insan topluluklarına uygulanan bir aşının koruyuculuğu her birey için aynı olmaz. Her şeyden önce, bağışıklık kazanılması aşılanan kişinin kendi bağışıklık sisteminin çalışmasına bağlıdır. Bu bakımdan, genel nüfus içinde, bir aşı hiçbir zaman yüzde yüz koruyucu değildir. Beklentiler COVID-19 aşısının en az %50 koruyuculukta olması gerektiği şeklinde [2].
Bazen aşı hastalanmayı önleyemez ama onu daha hafif atlatmaya yarayabilir. Bu durum da toplum sağlığı açısından faydalı olabilir. Böylelikle, örneğin, yoğun bakım ihtiyacı gösteren hastaların sayısı azaltılabilir ve sağlık sistemi üzerindeki yük hafifletilerek yeterli hizmet alamayan birçok hasta kurtarılabilir.
İlaçlar piyasaya çıktıktan sonraki araştırmaların önemi
Aşağıda ayrıntılarıyla anlatacağımız araştırma safhasında aşıların ne ölçüde etkili ve güvenli oldukları bir yere kadar saptanabilir. Toplum içinde yaygın kullanım sırasında ortaya çıkan etkilerin görülme sıklıklarının da bilinmesi önemlidir. Aşıların bağışıklık sistemi bozuk olan ya da eş zamanlı başka hastalıklarla mücadele eden kişilerde kullanımı veya yaşlılar ve hamileler gibi özel gruplar üzerinde önceden saptanamayan istenmeyen etkileri, aşı kullanılmaya başlandıktan sonra sürekli olarak izlenir. Bu izlem süreci farmakovijilans (ruhsat sonrası güvenlilik) olarak adlandırılır. Yani aşının piyasaya çıkması ile veri toplama bitmez. Gerektiğinde yeni bilgiler ışığında kullanım talimatları ve uyarılar güncellenebilir.
Tüm ilaç ve aşılar faydalı ve zararlı (advers) etkilere sahiptir. Her bir klinik durum için yapılan fayda-zarar analizi aşıların kullanım durumlarını belirler. Bu analiz aşağıda daha ayrıntılı olarak değinilen faz araştırmaları sırasında belli bir düzeye kadar yapılabilir ama esas değerlendirme müstahzar kullanılmaya başladıktan sonra piyasada yapılan takiplerle olur. COVID-19 aşısının kullanıma girmesinden sonra ender görülecek etkilerin takip edilmesi için şimdiden mekanizmalar kuruluyor [3].
Risk analizi ve hedef kitlelerin belirlenmesi
Hastaya ciddi zarar verme potansiyeli olan kanser ilaçları gibi toksik ilaçlar hastalığın niteliği ve öldürücülüğü göz önüne alındığında faydası zararından fazla olduğu için kullanılırlar. Aynı durum aşılar için de geçerlidir. Ebola gibi öldürücülüğü çok yüksek hastalıklar için geliştirilen aşılar, olası riskler büyük olsa da kullanılabilir. Ama toplumun büyük çoğunluğunun nispeten hafif geçirdiği bir hastalık için aynısı söylenemez. Halen içinde bulunduğumuz COVID-19 pandemisinde bu analizin basitçe siyah-beyaz gibi kolay bir seçim olmayacağı anlaşılıyor. Hastalığın öldürücülüğü nispeten düşük olmakla birlikte risk grupları içinde ciddi hastalık oluşturma potansiyeli var. Ayrıca yüksek yayılma hızı aşının en azından belli gruplara öncelikle uygulanmasının doğru olacağını gösteriyor. Hastalığa yakalananların sayısı arttıkça elde edilecek bilgilerin bu konuda öngörü oluşturmak için önemli bir kaynak olacağı kuşkusuz.
Covid19 aşı adayları
Halen farklı ülkelerde 202 adet COVID-19 aşı adayı geliştirilme aşamasında. Bunlardan 25’i klinik araştırma evresine geçmiş, 5 tanesi de faz 3 aşamasına erişmiş durumda [4]. Toplamda 8-10 aşı müstahzarının 2021 yılında erken kullanım şansı elde edebileceği tahmin ediliyor. Hastalık hakkında bilgilerimizin çok yeni ve yetersiz oluşu yanında, geliştirilen aşıların etkili ve güvenli olduklarına ilişkin verilerin de tam olarak elde edilemeyeceği dikkate alınırsa, çok sayıda alternatif aşının geliştiriliyor olması bir avantaj. Bu durumu kaba bir benzetmeyle “tüm yumurtaları aynı sepete koymamak” gibi ifade edebiliriz.
Aşı ve ilaç araştırmaları
Aşı ve ilaç araştırmaları bağımsız etik kurulların uygun bulması koşuluyla, ilaç ruhsatlandırma otoritelerinin denetiminde gerçekleştirilir. İlaç/aşı ruhsatlandırma otoritelerinin veriye güvenmediği durumda olumlu karar vermesi mümkün olmadığından, araştırmalar sırasında elde edilecek verinin kalitesi karar vericiler için son derece belirleyicidir. İlaç geliştirme çalışmalarında önde gelen Kuzey Amerika, Avrupa ve Japonya’nın öncülüğünde kurulan, Türkiye’nin de 2020 yılında tam üyesi olduğu Uluslararası Harmonizasyon Konseyi’nin (International Council of Harmonisation-ICH) kılavuzlarına uygunluk aşı ve ilaç geliştirmede önemli bir güvence sağlıyor.
Sağlık Bakanlığı Türkiye İlaç ve Tıbbi Cihaz Kurumu (TİTCK) gibi sağlık otoritelerinin aşının geliştirme ve üretim aşamalarında hangi verilerin elde edildiğini, etik kurallara uygunluğunu, üretim yerlerinin ve kalitesinin durumunu inceleme ve gerektiğinde her türlü açıklamayı talep etme hakkı ve yetkisi bulunuyor. Süreçlerin ne ölçüde şeffaf ve açıklanabilir olduğu aşı ya da ilaca güvenilirliğin de bir ölçüsüdür.
Covid aşı çalışmalarındaki çıkışlar: Hindistan ve Rusya
Hindistan Tıbbi Araştırma Kurulunun bir yerel firma ile ortaklaşa geliştirdiği COVID-19 aşısının 15 Ağustos gibi erken bir tarihte kullanıma girebileceğine ilişkin haberler karşısında Hindistan Bilimler Akademisi sürecin standart takvime uygun ilerlemesinin mümkün olamayacağı gerekçesiyle karşı çıkmış ve kamuoyunu bilgilendiren bir basın açıklaması yaptı [5]).
Rusya Federasyonu Devlet Başkanı Vladimir Putin 11 Ağustos’ta düzenlenen bir basın toplantısıyla yeni geliştirilen Sputnik V adlı aşının Dünya’da ulusal sağlık otoritesi tarafından onaylanan ilk aşı olduğunu açıkladı. Ancak, hemen ardından medyada yer alan aşının faz III denemelerinin henüz yapılmadığı ve faz II sonuçlarının bilinmediği haberleri etkililik ve güvenlilik açısından bir kuşku yarattı [6]. Konuyla ilgili olarak birçok bağımsız hekim kuruluşu ve sivil toplum örgütleri de kaygılarını dile getirdi. Geliştirilmekte olan COVID-19 aşılarının hızla kullanıma girebileceğine ilişkin açıklamalara Dünya Sağlık Teşkilatı (DSÖ)’nın da kuşkuyla yaklaşması bilimsel liyakat ve ruhsatlandırma standartlarının ne kadar titizlikle uygulandığının bilinememesinden kaynaklanıyor.
Bağışıklık yanıtının gelişmesi zaman aldığından, aşı klinik araştırmaları kaçınılmaz olarak uzun sürer. Koruyuculuk oranlarının belirlenmesi de geniş gruplarda uzun süren araştırmalara ihtiyaç duyar. Hal böyleyken, kısa sürede aşının hazır olduğu yönündeki açıklamalara her zaman temkinli yaklaşmak gerekir.
Aşı geliştirme süreçleri
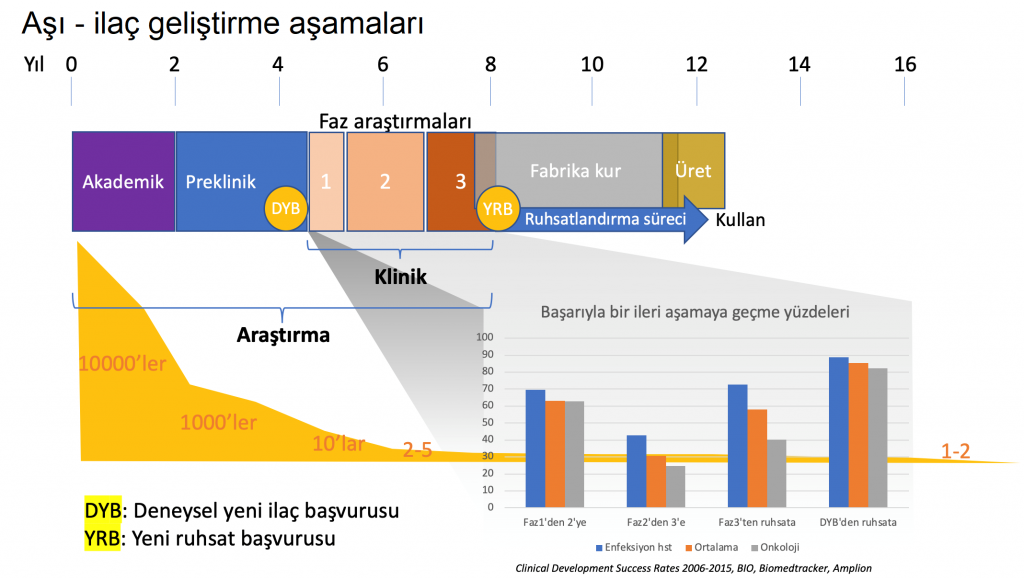
Aşıların geliştirilmesi uzun yıllar alır. Örneğin HPV ve rotavirüs aşıları için ilk başvurudan itibaren ruhsatlandırılıncaya kadar 14-16 yıl gibi uzun süreler geçmesi gerekmişti [7]. Elbette pandemi durumunun ciddiyeti aşı geliştirme çalışmalarının hızlandırılmasını zorunlu kılıyor. Fakat bu süreç halk sağlığını riske atmadan ne ölçüde hızlandırılabilir, yaygın aşılama programlarına ne kadar kısa sürede başlanabilir?
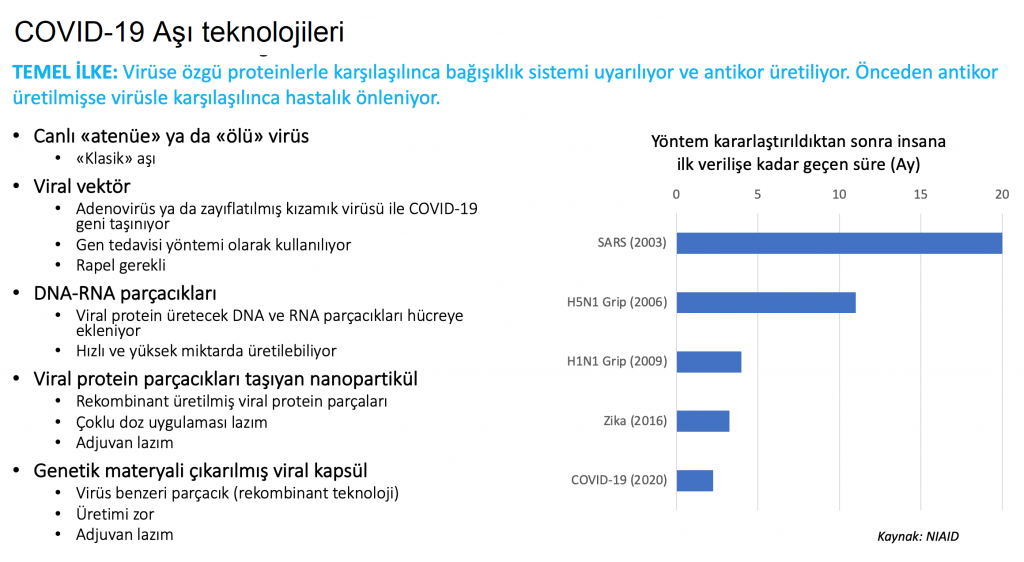
2003’te yine bir koronavirüs olan SARS salgını için başlatılan aşı geliştirme çalışmalarının hızla COVID-19’a uyarlanabilmesi sayesinde, COVID-19 aşı çalışmalarında preklinik aşamadan insanda ilk denemeye birkaç ay gibi rekor bir sürede geçilebildi [8].
Aşı ve ilaç geliştirme süreçleri birbirine benzer olsa da başta çocuklar olmak üzere sağlıklı bireylere uygulanması sebebiyle aşıların ruhsatlanması birçok ilaçtan daha sıkı ve titiz koşullara bağlanmıştır. Tasarım aşamasından, üretim ve ruhsatlandırmaya kadar tüm süreç, zaman alan riskli ve masraflı basamaklara ayrılır. Başlangıçta aday olan çok sayıda aday molekül daha klinik araştırma evrelerine bile gelemeden elenir. Sonunda ancak sınırlı sayıda molekül ilaç olarak ruhsatlanarak kullanıma girer. Örneğin, Avrupa İlaç Ajansı (EMA) tarafından 2019 yılında ruhsatlanan yeni molekül sayısı sadece 30’dur. Bunlar arasında tek aşı Ebola aşısıdır [9].
İlk basamak: Hangi teknoloji?Aşı geliştirmenin ilk basamağı hangi teknoloji ile, nasıl bir yöntem kullanarak bağışıklığın sağlanacağı konusunda bir karar verme aşamasıdır. Gerçek anlamda yenilikçi bakış isteyen bir aşama olan bu ilk etapta geliştirilecek aşı için bir yol haritası çıkarılır. Klasik aşılar hastalık etkeninin virulans olarak adlandırılan “hastalık yapma kapasitesi” ortadan kaldırıldıktan sonra insana verilmesiyle antijenik yanıtın ortaya çıkmasını sağlarlar, yani aşı olan insanda bağışıklık sistemi virüsü önceden tanır ve ona karşı antikorlar oluşturur. Hastalık etkeni ile karşılaşıldığında vücut bu savunma sistemi yardımıyla etkin bir şekilde mücadele edebilir. Aşılarda ayrıca adjuvan adı verilen bağışıklık yanıtlarını katlayarak artıracak ek maddeler de bulunur. Adjuvan tasarımı ve geliştirilmesi de ayrı bir araştırma alanıdır.
Pandeminin olağanüstü koşulları daha önce denenmemiş yöntemlerin hızla hayata geçirilmesi için de önemli bir fırsat. COVID-19 aşısı için moleküler biyoloji ve genomik teknolojiden yararlanarak geliştirilen RNA-DNA temelli genetik aşılar ya da viral vektörler kullanarak insan hücresine antijenik özellikteki virüs proteinlerini üretme kapasitesi kazandıran daha önce denenmemiş yenilikçi yöntemler de klinik araştırma aşamasına geldi. Ancak, denenmemiş yöntemlerin hangi öngörülemeyen riskleri içerdiği de bir diğer önemli tartışma konusu. Bu tip yaklaşımların denenebilmesi virüsün yapısının aydınlatılması ve yaşam döngüsünün belirlenmesi ile mümkün olur. Salgının başında viral genom dizisi (virüsün genetik bilgisi) belirlenmesi ve açık kaynak olarak tüm araştırmacıların hizmetine sunulması son derece önemli oldu.
İkinci basamak: Laboratuvar ve hayvan deneyleri
Uygulanacak teknoloji ve yöntemin seçilmesinden sonra ilk yapılacak iş, bu yöntemin deneysel olarak işe yarayıp yaramadığının gösterilmesidir. Bu aşamada in vitro (laboratuvarda) hücre kültürü ve hayvan deneyleri kullanılarak “yöntemin çalıştığı kanıtlanır (proof of concept)”.
Her hastalık etkeni (virüs vb) her canlı türünde hastalık meydana getirmez. Nitekim COVID-19 yarasalardan insana bir ara konakçı üzerinden birkaç basamaklı bir mutasyon süreci ile bulaştırıcılık kazanmıştır. Burada özellikle deney hayvanlarında geliştirilen hastalık modellerinde aşının koruyucu olduğu gösterilmeli ve akut ve kronik toksik etkileri ayrıntılı olarak tanımlanmalıdır. Bu nedenle uygun deneysel modellerin geliştirilmesi aşı çalışmalarının hızlandırılmasında kritik bir basamaktır.
Aşı olma potansiyeli taşıdığına inanılan tasarımlar, düşük evrimsel gelişim basamaklarından başlayarak giderek insana yaklaşan memeli türlerinde test edilir ve olası etkileri ile canlılarda tolere edilebilirliği sınanır. İnsanlarda denenmeden önce ilaç ya da aşı adaylarının hayvanlarda denenmesi etik tartışmalara sebep olsa da riskler göz önüne alındığında yapılması zorunlu bir işlemdir. Sağlık otoriteleri aşının insanlarda denenebilmesi için hayvanlarda özellikle tek ve tekrarlayan doz toksik etkilerinin ne ölçüde belirlenmiş olduğu ve güçlü verilerle desteklenip desteklenmediğine dikkat eder. Hayvan deneyleriyle ayrıca insanda ilk kullanılacak dozun da tahmin edilmesini sağlayan veriler elde edilir. Bir sonraki basamak olan klinik çalışmalara katılacak gönüllülerin sağlığı ve esenliğini korumak temel önceliktir.
Üçüncü basamak: Gönüllü insanlarla klinik çalışmalar
“Preklinik” dönem olarak da adlandırılan hayvan deneylerini takiben, tüm beşerî ilaçlar “faz araştırmaları” başlığı altında birbirini takip eden basamaklar halinde insan klinik araştırmalarına alınır. İnsan deneylerine başlamadan fikri mülkiyet hakları tescil edilir ve sağlık otoritesine deneysel yeni ilaç başvurusu yapılır. Bu başvuru, ürün sahipleri için yeni ürüne ne ölçüde güvenildiğinin en önemli göstergesi ve büyük bir yatırım kararıdır.
Bir aşının ruhsat başvurusu için ardışık 3 fazdan oluşan bir klinik araştırma planı yapılır. Her fazda elde edilen sonuçlar analiz edilerek bir sonraki basamağa geçip geçmeme kararı verilir ve giderek daha büyük gönüllü gruplarını içerecek şekilde araştırmalar genişletilir. Bir fazdan başarıyla geçemeyen bir aşı aday olmaktan çıkarılır, çalışmalar sonlandırılır.
Burada temel ilke ortaya çıkabilecek risklerden mümkün olduğunca kaçınarak en etkili ve güvenli ürünü elde etmektir. Aşıyı geliştiren, ürünün etkili ve güvenli olduğunu ispat etmekle yükümlüdür.
Bu durum ilaç firmaları için önemli bir idari ve mali külfet demektir. Elde edilecek gelir maliyeti karşılamayabilir . Buna istenmeyen etkiler nedeniyle piyasadan çekilme riski ve aşı karşıtlığı gibi sosyal eğilimler de katıldığında, aşı araştırmaları ilaç firmaları için cazip bir alan olarak görülmez. Oysa aşılar toplum sağlığı için son derece büyük önem taşır. Aşılama eksikliği özellikle çocuk ve genç yaşta yaygın halk sağlığı sorunlarına ve önlenebilir hastalıkların yeniden hortlamasına sebep olabilir. Hükümetler ve DSÖ gibi uluslararası örgütlerin aşı geliştirilmesine destek olması ve uygun yatırım ortamının sağlaması yanında aşı üretimi ile idamesinin sürdürülebilir olması da gereklidir. Bu amaçla kâr amacı gütmeyen vakıflar ve araştırma kuruluşları son yıllarda önemli katkılar yapmaktadır.
Klinik araştırmalarda yan tutmayan (önyargısız) nesnel veri elde edilmesi esastır. Bunun için altın standart olarak, çift kör plasebo kontrollü randomize tasarımlar kullanılır. Yeni tedavi rastgele olarak seçilen bir grup gönüllüde plasebo, yani içinde etkin madde olmayan yalancı ilaçla yarıştırılır. Körleme, uygulamayı yapan hekim ve gönüllünün ikisinin birden hangi tedavinin verildiğini bilmeden çalışmaya katılmasıdır. Veri elde edildikten sonra körleme açılarak sonuçlar değerlendirilir. Örneğin, bir COVID-19 aşı adayının faz 1-2 klinik araştırmasında, tedavi grubuna yeni aşı yapılırken, karşılaştırma amacıyla, kontrol grubuna menenjit aşısı yapılmış ve aşıyı takip eden 6 aylık dönemde COVID-19 bağışıklığının hangi grupta geliştiği tek kör (gönüllü hangi aşının verildiğini bilmiyor) randomize tasarımla değerlendirilmiş [10]. Menenjit aşısı COVID-19’a karşı etkisiz olacağı için burada plasebo yerine geçiyor. Söz konusu aşının faz 3 araştırması devam ediyor.
Faz 1: Az sayıda gönüllü, ciddi yan etkilerin araştırılması, dozun belirlenmesi.
İnsanda ilk deneme olan faz 1 klinik araştırmalarda sayıları onlarla ifade edilen az sayıda gönüllü üzerinde aşının tolere edilebilirliğinin anlaşılması amaçlanır. Bu aşamada aşının koruyucu olup olmadığının anlaşılması önemli değildir. Bağışıklık sisteminin aşı yoluyla aktivasyonu her bireyde, örneğin hafif bir ateş yükselmesi gibi, az çok bir rahatsızlık yaratır. Ancak, ciddi yan etki olarak tanımlanan, sağlığı tehdit edici etkilerin saptanması ve sıklıklarının belirlenmesi kritik bir öneme sahiptir. Yeni aşıya gönüllülerin ne ölçüde tahammül edebildikleri ve uygun dozun saptanması faz 1’in başarıyla bitirilmesi olarak kabul edilir.
Faz 2: Daha çok gönüllü, yan etkiler + etkililik +doz ayarlarının araştırılması
Faz 1’i gönüllü sayısının yüzlere ulaştığı faz 2 takip eder. Bu aşamada aşının güvenli olmasının (tolere edilebilmesi, yan etkilerinin azlığı) yanı sıra etkili olup olmadığı da araştırılır. Bunun için ideal yöntem aşılamadan sonra gönüllüyü hastalık etkeni ile kontrollü olarak karşılaştırmak ve doğrudan koruyucu olup olmadığını anlamaktır. Fakat bu yöntem çoğu kez etik bakımdan kabul edilemez. Onun yerine aşıdan beklenen bağışıklık yanıtının hastanın serumunda saptanmasına dayalı dolaylı yöntemler kullanılır. Buradaki temel varsayım kanında yeterince yüksek antikor düzeyi saptanan gönüllülerin hasta olmayacağıdır.
Bu aşamada ayrıca doz ayarlamaları yapılır, çocuklar ve yaşlılar gibi farklı gönüllü gruplarında aşıya verilen yanıt değerlendirilir, aşılama sayısı belirlenir. Aşı geliştirme sürecini hızlandırabilmek adına faz 1 ile faz 2 birleştirilebilir ya da birbiri üzerine örtüştürülebilir.
Faz 3: Kalabalık bir gönüllü grubu, az görülen yan etkilerin saptanması, etkililik + güvenlik araştırmaları
Faz 3’te ise faz 2 genişletilerek çok daha büyük bir gönüllü grubunda deneme yapılır. Nispeten daha ender görülen yan etkilerin saptanması için olabildiğince büyük sayılara ulaşılması hedeflenir. Binlerce gönüllüde gerek etkililik gerekse güvenlilik verilerinin toplanması esastır. Faz 3 araştırmalar çok masraflı araştırmalardır. Bir araştırmanın bu aşamada öngörülemeyen istenmeyen etkiler nedeniyle yarım kalması ciddi bir başarısızlık sayılır. Bunun önlenmesi için preklinik evreden başlayarak elde edilen sonuçlar ciddiyetle ve yan tutmadan değerlendirilmelidir.
Üretim ve dağıtım
Faz 3’ün tamamlanmasıyla aşının ruhsatlandırılması için sağlık otoritesine başvurulur. Elde edilen veriler ve sonuçlar otorite tarafından değerlendirilir. Aşının hangi koşullarda, nasıl ve kimlere uygulanacağı uzman paneller tarafından kararlaştırılır. Bu sürecin olabildiğince kamuoyuna açık bir şekilde gerçekleştirilmesi önemlidir. Klinik araştırmaların seyrine göre aşıyı geliştiren firmalar ya da COVID-19’da olduğu gibi farklı kamu-endüstri-üniversite-sivil toplum örgütü konsorsiyumları ruhsatlandırmadan sonra üretim için planlarını oluştururlar. Pandemi gibi olağanüstü koşullar dışında, aşıların üretim planlaması ruhsatlandırmadan sonraya bırakılabilir ama içinde bulunduğumuz koşullarda zamana karşı yarış söz konusu olduğundan üretim ve dağıtımın aşı geliştirilirken planlanması gerekli. Nitekim, ileri aşamaya geçmiş birçok aşı projesi eş zamanlı olarak üretim imkanlarını da araştırıyor.
Tüm Dünya’yı etkileyen ve yüz milyonlarca dozun bir anda kullanılması öngörülen aşıların üretimini yapabilecek tesislerin varlığı, kurulumu ve aşının üretilmesi önemli teknolojik, lojistik sorunların çözülmesini gerektiriyor. Biyolojik aşıların büyük hacimlerde üretilmesi laboratuvar ortamında küçük ölçekte üretimden çok daha kompleks üretim proseslerinin geliştirilmesi ve optimize edilmesini zorunlu kılıyor. Virüsün büyük miktarlarda üretilmesini gerektiren klasik ölü virüs aşıları, DNA ya da RNA temelli genetik mühendislik ürünü aşılar kadar hızlı ve büyük ölçekte üretilemezler. Tüm bunlar aşı üretildikten sonra aşılamanın nasıl planlanacağı ve dağıtımın ve uygulamanın hangi ilkeler altında gerçekleştirileceğini gündeme getiriyor.
Aşının uygulanması
İdeal bir aşı doğru bir takvimle uygulandığında kişiyi tüm yaşamı boyunca korumalıdır. Sarı humma aşısı gibi bazı aşılar bir kere yapıldıktan sonra yaşam boyu bağışıklık sağlar. Ama başka bazı hastalıklarda bağışıklığı korumak için aşılama periyodik olarak tekrarlanmalıdır. Örneğin tetanoz aşısı 10 yılda bir tekrarlanır.
Hastalık etkenin geçireceği mutasyonlar da aşının etkisiz olmasına sebep olabilir. Bu durumda hızlı mutasyon geçiren grip virüsü gibi hastalık etkenlerinin farklı tiplerine (suşlar) karşı her seferinde yeni aşı yapmak gerekir.
Aşılama herkesin ayrımcılığa uğramadan eşit koşullarda erişebilmesi gereken bir sağlık hakkıdır. Bireyin görevi de aşılanarak kendini hastalıktan korumak ve böylece hastalığın toplumda yayılmasını önlemektir. Sürü bağışıklığına bu şekilde ulaşılması beklenir.
İlk aşamada risk altındaki sağlık çalışanları ve ağır hastalık riski taşıyanların aşılanması düşünülmektedir. Birçok aday aşının en az iki defa uygulanması gerekeceği tahmin ediliyor. Dolayısıyla, ancak birkaç yüz milyon aşı dozu üretildikten sonra genel toplum aşılamasına geçilebilir. Aşı keşfedilmesi dışında, epidemiyoloji, üretim ve lojistik alanlarında da araştırmalarının yapılmasına ve politikaların geliştirilmesine ihtiyaç var.
Bulaşıcı hastalıklarla mücadele ülkelerin ortaklaşa çalışmasını ve dayanışmayı gerektiriyor. Nitekim birçok faz 3 araştırması daha yüksek gönüllü sayılarına çıkabilmek için değişik ülkelerde eş zamanlı olarak başlatıldı [11]. Her ülke kendi aşı politikasını geliştirse de bir Birleşmiş Milletler kuruluşu olan DSÖ bu alanda hem düzenleyici-izleyici hem de koordinatör olarak önemli bir rol oynuyor.
2009 H1N1 influenza salgını sırasında aşı konusunda yaşanan olumsuz deneyimlerin ışığında DSÖ salgınlar ve pandemi gibi acil durumlara yönelik stratejik harekât planlarını güncelledi. Ancak, bir Birleşmiş Milletler kuruluşu olarak ülkelerin egemenlik haklarına karışması söz konusu değil. Güçlü ve bilimsel araştırmada ileri gitmiş ülkelerin yeni buluşları ne ölçüde insanlığın kullanımına sunacakları kendileri tarafından belirleniyor. Aşıya eşit ve hakkaniyetli erişim, bireyler arasında olduğu kadar ülkeler arasında da erişilmesi güç bir hedef olarak görülüyor. Aşıyı geliştiren ülkelerin onu bencilce kendilerine saklaması ve bir güç aracı olarak kullanmaları, başka bir deyişle aşı milliyetçiliği yapmaları, etik bakımdan olduğu kadar uluslararası ilişkiler bakımından da sıkıntılı, ancak var olan jeopolitik konjonktür içinde çözülmesi mümkün olmayan bir konu olarak duruyor [12]. Düşük-orta gelirli ülkelerin aşıya erişimi için oluşturulan fonlar sadece bu ülkelere yönelik aşı üretimi için daha şimdiden önemli üreticilerle anlaşmalar yapıyor [13] Ancak, eldeki kaynakların ihtiyacı karşılayamayacağı ortada.
Yaşanan gelişmeler ışığında, pandemiyi durdurması ümit edilen aşıların 2021 başlarından itibaren kullanıma girecekleri söylenebilir. Etkili ve güvenli aşılar olarak üretilmeleri ve hakkaniyete uygun şekilde tüm insanlığın hizmetine sunulmaları herkesin büyük bir beklentisi. Sürecin uzaması ve adaletsizlik global ekonomik sorunların ve sosyal krizin derinleşmesine yol açabilir. Her ne olursa olsun, pandeminin yarattığı ekonomik sorunlarla olduğu gibi hastalıktan korunmak için de daha uzun süre mücadele edilmesi gerekecek. Salgınlarla mücadele sadece ilaç ve aşılar gibi mucizevi etkileri olan teknolojik ürünlerle kazanılmaz. Kişisel sorumluluk ve toplumsal disiplin içinde koruyucu sağlık kurallarına uyulmasının önemi ve destekleyici sosyal politikalar hiçbir zaman geri plana atılmamalıdır.
Hakan S. Orer
Bilim Akademisi üyesi
Koç Üniversitesi Tıp Fakültesi Tıbbi Farmakoloji Anabilim Dalı
Kaynaklar
[1] The Economist, Operation Warp Speed. Donald Trump is hoping for a covid-19 treatment by November. 18 July 2020. https://www.economist.com/united-states/2020/07/18/donald-trump-is-hoping-for-a-covid-19-treatment-by-november. [Erişim tarihi: 17.08.2020]
[2] S. Food and Drug Administration (FDA), Development and Licensure of Vaccines to Prevent COVID-19. Guidance for Industry (2020), https://www.fda.gov/media/139638/download
https://www.ias.ac.in/public/Resources/News/IASc_Press_Release.pdf [Erişim tarihi: 17.08.2020]
[3] EMA commissions independent research to prepare for real-world monitoring of COVID-19 vaccines https://www.ema.europa.eu/en/news/ema-commissions-independent-research-prepare-real-world-monitoring-covid-19-vaccines
[4] Milken Institute, COVID-19 Vaccine Tracker (2020) https://www.covid-19vaccinetracker.org [Erişim tarihi: 17.08.2020]
[5] Development and Licensure of Vaccines to Prevent COVID-19. Guidance for Industry (2020), https://www.ias.ac.in/public/Resources/News/IASc_Press_Release.pdf [Erişim tarihi: 17.08.2020]
[6] Callaway E. Russia’s fast-track coronavirus vaccine draws outrage over safety [published online ahead of print, 2020 Aug 11]. Nature. 2020;10.1038/d41586-020-02386-2. doi:10.1038/d41586-020-02386-2
[7] Douglas RG and Samant, VB. The Vaccine Industry in Plotkin’s Vaccines 7th Ed., s. 43, 2018.
[8] Kim YC, Dema B, Reyes-Sandoval A. COVID-19 vaccines: breaking record times to first-in-human trials. NPJ Vaccines. 2020;5:34. Published 2020 Apr 30. doi:10.1038/s41541-020-0188-3
[9] European Medicines Agency (EMA). Human medicines highlights 2019. https://www.ema.europa.eu/en/documents/report/human-medicines-highlights-2019_en.pdf [Erişim tarihi: 17.08.2020]
[10] Folegatti PM, Ewer KJ, Aley PK, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial [published correction appears in Lancet. 2020 Aug 15;396(10249):466]. Lancet. 2020;396(10249):467-478. doi:10.1016/S0140-6736(20)31604-4)
[11] The New York Times. Coronavirus vaccine tracker, https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html [Erişim tarihi: 17.08.2020]
[12] Fidler DP. Vaccine nationalism’s politics. Science. 2020;369(6505):749. doi:10.1126/science.abe2275
[13] 100 million COVID-19 vaccine doses available for low and middle-income countries https://www.gavi.org/news/media-room/100-million-covid-19-vaccine-doses-available-low-and-middle-income-countries-2021 [Erişim tarihi: 17.08.2020]