Bugün mücadele ettiğimiz SARS-CoV-2 (HCoV-19, COVID-19) betakoronavirüsü insanlara bulaşabilen yedinci koronavirüs olarak tanımlandı [1,2].
SARS-CoV-2 daha önceki SARS-CoV ve MERS-CoV salgınlarında olduğu gibi insanlarda şiddetli semptomlarla seyreden hastalıklara neden olurken HCoV-OC43, HCoV-HKU1, HCoV-NL63 ve HCoV-229E enfeksiyonları daha hafif seyreder.
İlk sorumuz şu: Neden SARS-CoV-2 ile SARS-CoV ağır klinik tabloya ve yüksek ölüme sebep olurken, diğer koronovirüsler oldukça hafif seyreden soğuk algınlığı yapıyorlar?
Sorunun cevabı ise basit: henüz bilmiyoruz.
19 Mart 2020 itibariyle NCBI data bankasında SARS-CoV-2‘nin genetik maddesinin 174 adet eksik ya da tam dizilim (sekans) verisi mevcut, bunların büyük bölümü Çin ve ABD girişleri. Nature Medicine ve Lancet dergilerinde yayımlanan karşılaştırmalı dizilim verisine göre de SARS-CoV-2‘nin öncelikli hücreye giriş bölgesi SARS-CoV da olduğu gibi ACE2 insan hücre zarı alıcı proteini [1,2]. Basitçe SARS-CoV-2, çıpa (spike*, çivi, kanca) olarak isimlendirilen protein bölgesini kullanarak ACE2 reseptörüne bağlanıyor, bu virüsün hastalık yapma potansiyeli için en önemli protein bölgesi (Şekil 1, (CC BY-NC-ND 4.0)).
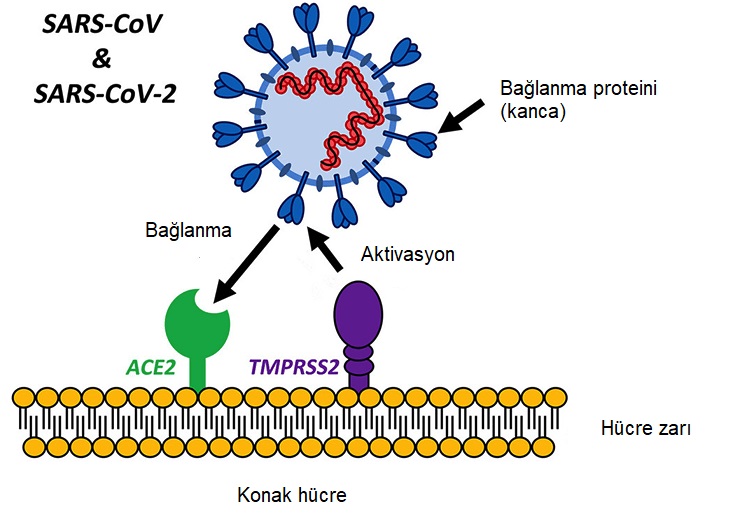
SARS-CoV-2’de virüsün aktive olması için furin tarafından bir makas gibi kesilip ayrılması gereken bölge mevcut, bu bölgeyi furin -PRRAR- amino asit dizisinden tanıyor ve hangi bölgeyi keseceğini anlıyor. Bu tanıma bölgesi SARS-CoV virüsünde bulunmuyor.
Furin proteaz, insan solunum sistemi hücrelerinde yaygın olduğundan SARS-Cov-2’nin hem üst hem de alt solunum sistemlerini bu derece kolaylıkla ve etkin tutuyor. Virüsün çıpa, yani ACE2 bağlanma bölgesi hücrelere girmesini sağladığına göre virüsün yayılmasına yarayışlı mutasyonların önemli bir kısmının çıpasını kodlayan RNA diziminde gerçekleşmesini bekliyoruz.
SARS-CoV-2’de özellikle 6 amino asit (L455, F486, Q493, S494, N501 ve Y505) bu bağlanmanın moleküler seviyede gerçekleşmesi için önem taşıyor. Biz de kendi modellemelerimizde özellikle Q493 amino asit kalıntısının ACE2 bağlanma sürecinin en kritik düzenleyicisi olduğunu tahmin ettik. Buradaki önemli husus, SARS-CoV-2’nin bu altı amino asit kalıntısından beş tanesi SARS-CoV’dan farklı, virüs yararına mutasyonlarla kazanılmış olan bu 5 ilave amino asit etkinliği dolayısıyla SARS-CoV-2, SARS-CoV ve diğer koronovirüslerden daha yüksek bağlanma eğilimiyle ACE2’ye bağlanıyor, bu özellikle insan ACE2 reseptörü için dramatik derecede yüksek (laboratuvarda yapılan bağlanma analizlerine göre SARS-CoV’a göre yaklaşık 20 kat daha fazla).
Yaşadığımız pandemide SARS-CoV-2 yüksek bulaşma gücünün ana nedeni de bu farklılık.
İnsan ACE2 reseptörlerine bağlanma eğilimi yüksek olan virüsün şu ana kadar gördüğümüz birinci dalga salgınında daha çok solunum sistemini tuttuğu, akabinde solunum yetmezliğine bağlı olarak çoklu sistem yetmezliği ile ölüme neden olduğu gözlendi. SARS-CoV-2 hastayla temas ettiğinde yüksek seviyede ACE2 bulunan solunum sistemi hücrelerini enfekte ediyor, doku hasarı ile beraber hücre artıkları solunum sisteminin tamamını virüs ile beraber doldurmaya başlıyor. Akciğerlerin radyolojik görüntülemesinde gözlemlenen buzlu cam görüntüsünün nedeni alveollerin (akciğer baloncuklarının) sıvı, hücre (bağışıklık sisteminin hücreleri, hücre kalıntıları, protein) ile dolması nedeniyle havalanmada azalma gerçekleşmesidir. Bağışıklık sisteminin aşırı tepki vermesi sonucu oluşan sitokin (bağışıklık sistemi hücrelerinin ürettiği protein yapıları) fırtınası, CoVid19 hastalarında ARDS’nin (Akut solunum yetersizliği sendromu – acute respiratory distress syndrome) ve ölümün önemli nedenlerinden birisi.
(Editör notu: COVID19 pandemisi dolayısıyla bilimsel çalışmalar her zamankinden çok daha hızlı ilerliyor. Bilim insanları sonuçlarını hızla dünyadaki diğer bilim insanlarıyla paylaşıyorlar ve dünyanın her tarafında bu sonuçlar yeni deneylerle test ediliyor. Bu konudaki bilimsel gelişmeleri takip ederken bugünlerin olağandışı günler olduğunu unutmayın. Paylaşılan bilginin yayınlandığı tarihi ve bilimsel bilginin bir kısmının zaman içinde değişebileceğini dikkate alın.)
Ancak bu hafta içerisinde yayımlanan iki çalışmada yeni ortaya çıkan vakalarda sindirim sistemi tutulumunun giderek daha ön plana çıktığı, özellikle çocuklarda ateş ile beraber sadece bulantı, karın ağrısı, kusma ve ishal ile başvuran CoVid19 hastaları olduğu belirlendi [3,4]. Ayrıca solunum sıkıntısı, öksürük ve ateş ile başvuran hastalarda bu duruma ishal ve kusma eşlik ediyorsa hastalığın seyri çok daha ağır oluyor.
Kuzey ve kuzeybatı İtalya’da alanda çalışan meslektaşlarımızla yaptığımız görüşmelerde Güney Kore, Çin, Türkiye ve ABD’deki hastalarda kısmen de olsa yarar gösteren hidroksiklorokin’n İtalya’daki hasta grubunda hiç çalışmadığı belirtildi. Bu farklılığın virüsün farklı coğrafyalarda farklı mutasyonları gerçekleştiriyor olmasından mı yoksa farmakodinamik/farmakogenetik (ilaç dinamiğinde bireyin kalıtsal özelliklerine göre) değişkenlikten mi kaynaklandığını henüz bilmiyoruz.
Mutasyon gelişimi – Bizi neler bekliyor?
SARS-CoV-2 mutasyon gelişimine dair iki temel sorunumuz mevcut.
- Birincisi CoVid19 artık bir pandemi, dolayısı ile farklı bağışıklık sistemi yapılarına sahip insan popülasyonlarında SARS-CoV-2 farklı mutasyonlara, farklı hızlarda ve farklı kalıcılıklarla ulaşabilir.
- İkinci olarak maalesef elimizde herkes tarafından bilinip kullanılan bir tedavi protokolü olmadığı için aktif hasta tedavisinde her ülke hidroksikinolon, anti-viral moleküller, humanize edilmiş antikorlar, tirozin kinaz inhibitörleri veya CAR-T-temelli bağışıklık tedavisi uygulamalarını yürütüyor. Bu durum virüsün farklı tedavi uygulamalarının baskısı altında, tüm bu tedavilere ayrı ayrı direnç geliştiren yüzlerce çeşidine neden olabilir.
22 Mart 2020 itibariyle henüz dominant karakter gösteren, öne çıkan bir mutasyon belirlenmiş değil, yani virüsü izolasyon ya da kullandığımız tedavi yöntemleri ile değişime zorlayabilmiş değiliz. Bu virüse karşı evrimsel seçici bir baskıyı -henüz- oluşturmayı başaramadığımızın bir göstergesi.
Mutasyonların moleküler düzeyde tanımlanması için elimizde henüz geniş veri setleri de mevcut değil. Güncel olarak tanımlanmış SARS-CoV-2 değişim tipi mutasyonlarının sayısı 22 Mart 2020 tarihi itibariyle 301, delesyon (silinme) mutasyonların sayısı ise 8 (http://cov-glue.cvr.gla.ac.uk/#/home). Ancak bu mutasyonların translasyonel (klinik ile ilişkili) ya da virüste dönüşüme yol açacak, işlevsel düzeyde etkilerinin tanımlanması gerekiyor. Bu bağlamda yapılan ve coğrafi verileri de içeren en bütünsel çalışmalardan birisi biyoloji makalelerinin ön baskılarının yayınlandığı internet sitesi BioRxiv’de 17 Mart 2020 tarihinde açık kullanıma açılmış durumda [5]
(bioRxiv yaşam bilimleri alanında henüz yayınlanmamış ve hakem değerlendirmesine girmemiş makaleler için kullanılan bir arşiv ve açık erişim dağıtım servisidir. Sistemde sunulan makaleler bir dergide yayımlanana kadar bilim insanlarının erişimine ve eleştirisine açıktır. Dolayısıyla bu sonuçlar değişebilir).
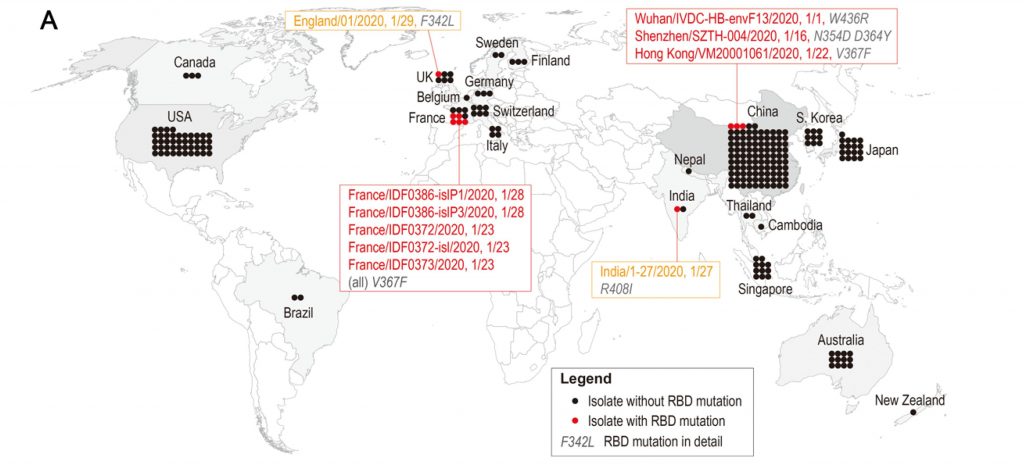
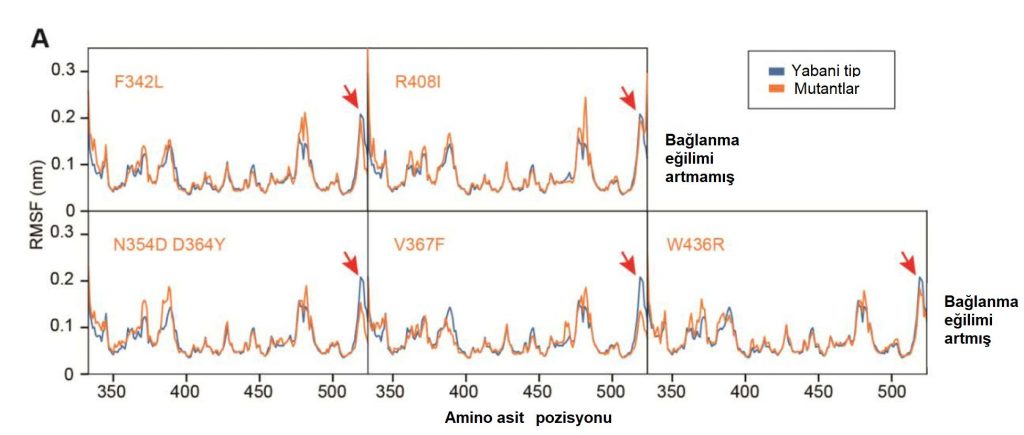
21 farklı ülkeden 244 tam genom verisi bulunan SARS-CoV-2 örneklerinin analiz edildiği çalışmada 10 suş (insandan alınmış farklı virüs örnekleri, strain*) arasında 6 farklı çıpa reseptör bağlanma bölgesi mutasyonu tespit edilmiş (Şekil 2). 9 örnekteki mutasyon tek amino asit değişikliğine yol açarken, Shenzhen-SZTH-004 suşunda iki amino asit değişikliği bulunmuş. Mutasyon V367F 4 hastadan izole edilen 6 suşta tespit edilmiş, bu hastaların 3’ü Fransa 1’i ise Hong Kong, Çin kökenliymiş. Bu durum V367F mutasyonunun muhtemel ilk yani yeni bir virüs türü olduğunu gösteriyor. Tespit edilen SARS-CoV-2 çıpa reseptör bağlanma bölgesi mutasyonlarından F342L ve R408I yabani tip ile benzer bağlanma eğilimi gösterirken, N354D/D364Y, V367F ve W436R mutasyonları ACE2 ile daha yüksek bağlanma eğilimi göstermiş. Aynı zamanda V367F ve W436R mutasyonları çıpa reseptör bağlanma bölgesindeki “random coil” (rasgele sarmal) yapısını daha kararlı hale getiriyor (Şekil 3).
ACE2 bağlanmasını ölçen KD değerleri yabani tip için 14.7 nM iken N354D/D364Y için 0,12 nM, V367F için 0,11 nM ve W436R için 0,13 nM olarak belirlenmiş. Bu veri mutant suşların SARS-CoV-2 yabani tipe göre neredeyse yüz kat artmış hastalık yapma kapasitesine sahip olabileceğine işaret ediyor.
Sil baştan
Epidemiyolojik data ile beraber bu mutasyonların ortaya çıkması çok daha ciddi SARS-CoV-2 epidemilerine ve pandemilerine maruz kalabileceğimizin işaret fişekleri olarak kabul edilmelidir.
Neden sil baştan karatahtanın başına tekrar dönmemiz gerektiğine gelince, bunun üç temel nedeni var.
- Birincisi virüsün yayılım biçimi G7 ülkeleri de dahil sağlık organizasyonlarının epidemiyolojik modellerin büyük kısmının ya da halk sağlığı öngörülerin dışında ve oldukça saldırgan Ne Dünya Sağlık Örgütü ne de diğer BM kurumlarının yeterince müdahil olma ya da önlem alma şansı erken safhada olmadı.
- İkincisi dünya üzerindeki bir pandemiye karşı aşı ya da molekül geliştirme sistemlerinin ne kamu ne de özel sektörde yeterince hızlı olmadığı ortaya çıktı.
- Üçüncü olarak da karşımızda biyolojik olarak oldukça başarılı bir betakoronavirüs var, yani eskiden saldırdığı hayvanlardan insana geçmiş ve yeni konağında daha saldırgan patolojiye yol açabilecek mutasyonları ortalama hızın üzerinde gerçekleştirme kapasitesine sahip bir organizma. Ancak tüm konak popülasyonunu ortadan kaldırmayacak kadar sınırlı ölümcüllüğe neden olacak kadar ‘’moleküler akla’’ sahip – yani virüsün evrimi, kendine yararlı mutasyon üretme hızı bütün insanları öldürmeden bitecek: çünkü dünyanın bir yerinde herkesi öldürecek kadar azgın bir mutasyon çıkarsa insanlar ölünce o mutasyonu taşıyan virüs nüfusu da yok olacak.
Dolayısı ile şimdi, eğer atlatabilirsek bu pandeminin arkasından en azından ulusal salgın hastalık sistemini tüm bileşenleri ile yeniden kurgulamak gerekiyor. Bu mutlak ki yetişmiş insan, altyapı ve araştırma-geliştirme imkanlarının aynı anda aynı yerde bulunmasını gerektiriyor. Toplumun ve sağlık sisteminin örgütlenmesi daha hızlı ve etkin olmak zorunda, eğer olası daha şiddetli SARS-CoV2 pandemi dalgaları ile baş edebilmek istiyorsak.
NOT: Bu yazı yayına hazırlanırken SARS-CoV-2 mutasyonlarına ilişkin önemli bir ilk bulgu 24.03.2020 tarihinde İzlanda’dan bildirildi. DeCode Genetics tarafından yapılan dizileme çalışmasında aynı hastada eşzamanlı iki farklı SARS-CoV-2 suşu belirlendi, bir suş yabani tip (wild-type) iken diğer suş mutant tipteydi. Bu hastadan virüs bulaşan diğer hastalarda ise yalnızca mutant tip virüs vardı. Bulgular mutant virüsün daha yüksek bulaşma kapasitesi kazandığına işaret ediyor olabilir.
Özgür Kütük
Başkent Üniversitesi Tıp Fakültesi, Adana Dr. Turgut Noyan Uygulama ve Araştırma Merkezi
BAGEP 2015
Notlar/Kaynaklar
[1] Andersen, K.G., Rambaut, A., Lipkin, W.I. et al. The proximal origin of SARS-CoV-2. Nat Med (2020). https://doi.org/10.1038/s41591-020-0820-9
[2] Lu R, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020;395(10224):565–574. doi:10.1016/S0140-6736(20)30251-8
[3] Pan L, et al., Clinical characteristics of COVID-19 patients with digestive symptoms in Hubei, China: a descriptive, cross-sectional, multicenter study, The American Journal of Gastroenterology.
[4] Epidemiological Characteristics of 2143 Pediatric Patients With 2019 Coronavirus Disease in China. Yuanyuan Dong, Xi Mo, Yabin Hu, Xin Qi, Fang Jiang, Zhongyi Jiang, Shilu Tong. Pediatrics Mar 2020, e20200702; DOI: 10.1542/peds.2020-0702
[5] RBD mutations from circulating SARS-CoV-2 strains enhance the structure stability and infectivity of the spike protein. Junxian Ou, Zhonghua Zhou, Jing Zhang, Wendong Lan, Shan Zhao, Jianguo Wu, Donald Seto, Gong Zhang, Qiwei Zhang bioRxiv 2020.03.15.991844; doi: https://doi.org/10.1101/2020.03.15.991844





