Kanser oluşumu ve mutasyonların önemi
Kanser, vücudumuzdaki hücrelerin kontrolsüz bölünüp çoğalmaları ve/veya ölmemeleri sonucu meydana gelen karmaşık ve ölümcül bir hastalık grubunun genel adıdır. Hücrelerin büyümesinde rol alan proto-onkogenlerdeki ve kontrolsüz hücre çoğalmasını engelleyen tümör baskılayıcı genlerdeki düzensizlikler kanser oluşumundan sorumlu tutuluyor. Bu düzensizliklerin önemli bölümünden sorumlu olan genetik değişikliklere mutasyon deniliyor. Bu mutasyonlar, ebeveynlerden kalıtsal olarak geçebileceği gibi somatik de olabilir. Somatik mutasyonlar, sperm ve yumurta harici hücrelerde olan ve çocuklara aktarılmayan genetik değişiklere denilmektedir. Somatik mutasyonlar sadece tümörü oluşturan hücrelerde bulunurken, anne veya babadan geçen kalıtsal mutasyonlar bireyi oluşturan tüm hücrelerde bulunur. Çeşitli kanserlere neden olan mutasyonların büyük bölümünün somatik karakterde olduğu biliniyor ancak kalıtsal olarak aktarılan mutasyonlar da mevcut. Bu mutasyonların tümör dokularında belirlenmesi, kanser türlerinin tanı ve tedavisine yönelik önemli katkılar sunuyor.
Kansere yakalanma riskini arttıran genetik faktörler belirlenebilir mi?
Evet, bazı kanser türleri için bu mümkün. Kalıtsal olarak aktarılan mutasyonların veya tek nükleotid polimorfizmlerinin (SNP) çeşitli kanserlere yatkınlığı arttırdığı uzun süredir biliniyor. Bu bağlamda en önemli kanser yatkınlık genleri arasında BRCA1 ve BRCA2 gösterilebilir. Bu iki gendeki mutasyonlar, meme ve yumurtalık kanserlerinin görülme sıklıklarını ürkütücü boyutta arttırıyor[1]. Dolayısıyla bu genlerin mutasyon taraması yoluyla risk altındaki bireyler belirlenerek erken kanser tanısı konması ve mümkünse önlenebilmesine yönelik girişimler var[2].
Bir kanser grubu olarak lenfomalar
Beyaz kan hücreleri olan B, T, ve NK lenfositleri, hastalık yapan mikroorganizmalara ve tümör oluşumuna karşı vücudumuzu koruyan bağışıklık sisteminin hücresel bileşenleridir. Sağlığımızı koruma görevi olan bu hücrelerin büyümesini ve çoğalmasını kontrol eden moleküler mekanizmalardaki bazı bozukluklar bu hücrelerin kontrolsüz çoğalmasına neden olup tümör dokusu ve kanser oluşumuna neden olabilirler. Lenfositlerin kontrolsüz çoğalıp oluşturduğu çeşitli kanser türlerine lenfoma denilir. Pek çok farklı alt tipi olan lenfomalar, klinik seyir bakımından oldukça farklıdır. Bazı lenfoma hastaları tanıdan birkaç ay sonra yaşamını yitirirken, bazıları ise klinik olarak ılımlı bir seyir sonucu yıllarca yaşamını sürdürebiliyor. Lenfomaların büyük bölümü olgun B hücrelerinden köken almakla birlikte, T ve NK hücre lenfomaları da mevcut.
NK/T hücre lenfoması nedir?
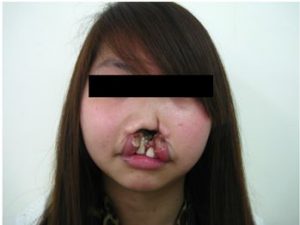
NK/T hücre lenfoması (NKTCL), çoğunlukla doğal öldürücü (natural killer [NK]) hücrelerin bazı durumlarda da T hücrelerinin üst solunum yollarında (örn. burun) veya göz, sindirim sistemi gibi vücut bölümlerinde tümör oluşturduğu agresif bir kanser türüdür. Tümörlerin oluştuğu bölgenin insan yüzünde olabilmesi nedeniyle NKTCL, hasta psikolojisi bakımından -diğer pek çok kanser türüne kıyasla- daha olumsuz ve dramatik etkileri olan bir hastalıktır (Şekil 1). Görece nadir bir kanser olmakla birlikte, NKTCL görülme sıklığı Uzak Doğu yanı sıra Orta ve Güney Amerika’da ilginç bir biçimde çok daha yüksektir[3]. Diğer kanser türlerinde olduğu gibi, geç aşamalarda tespit edilmesi durumunda NKTCL tedavisi oldukça güçtür; ve hastalık çoğu durumda ölümcüldür. Son yıllarda, NKTCL tümör oluşumunda rol alan somatik mutasyonların tespitine yönelik çeşitli çalışmalar önemli sonuçlar ortaya koydu[4].
NK/T hücre lenfoması dünyanın bazı kısımlarında neden daha yaygındır?
NK/T hücre lenfomalarının dünyanın bazı ülkelerinde (örn. Çin, Japonya) daha sık rastlanmasının nedeni, bu kanserin riskini arttıran kalıtsal genetik faktörler olabileceği gibi; beslenme alışkanlıkları, günlük yaşamda maruz kalınan bazı karsinojenler vb. çevresel faktörler de olabilir. Bu kanserin sıklığını arttıran sebeplerin belirlenmesi, NKTCL gelişiminin bilimsel temellerinin aydınlatılması yanı sıra –belki daha önemlisi- risk grubundaki bireylere bu kanseri önleyici doğrultuda müdahale edilmesini sağlayacaktır.
Uzak Doğu popülasyonlarının NK/T hücre lenfomalarına genetik yatkınlığı
İnsanlar birbirlerinden genomlarındaki tek nükleotid düzeyindeki genetik farklılıklarla ayrılır. Çoğu durumda herhangi bir hastalıkla ilişkili olmayan ve hastalık yapan mutasyonlara oranla insanlarda daha sık gözlemlenen bu tek nükleotid varyasyonları (SNP), bazı durumlarda sağlıklı bireylerin kanser gibi hastalıklara yakalanma riskini arttırabilir. SNP’ler ile hastalık oluşumu arasındaki ilişkiyi inceleyen kapsamlı genetik çalışmalara genom çapında ilişkilendirme çalışmaları (GWAS) adı verilir.
Çin Halk Cumhuriyeti’nin çeşitli bölgeleri yanı sıra Güney Kore, Singapur, Tayvan, ve Hong Kong’tan 1417 NKTCL hastası ve 20,402 sağlıklı kontrol grubu bireyini kapsayan bugüne kadar bu hastalık bağlamında gerçekleştirilmiş olan en kapsamlı GWAS çalışması, önceden yapılmış daha dar kapsamlı bir GWAS çalışmasında belirlenmiş olan HLA-DPB1 SNP’sinin teyidi yanı sıra IL18RAP ve HLA-DRB1 genlerinin her birinde birer adet yeni SNP’nin NKTCL gelişim riskini önemli ölçüde arttırdığını gösterdi[5]. Öyle ki, bu üç SNP’nin homozigot olduğu -yani genin her iki kopyasında da nükleotid değişikliği bulunduğu- sağlıklı bireylerde NKTCL gelişim riskinin 18,5 kat arttığı belirlendi[6].
Bu bulguların klinik yansımaları ve gelecekteki sorular nelerdir?
Uzak Doğu ülkelerindeki insanların NK/T hücre lenfomasına genetik yatkınlığıyla ilgili bu yeni bulgular, özellikle erken tanı bakımından önemli fırsatlar sunuyor. Sağlıklı bireylerin herhangi bir dokusundan (kan vb.) alınan hücrelerin dizi analizi yoluyla bu SNP taşıyıcıları belirlenip, NKTCL gelişim riskine karşı klinik olarak takip edilebilir. NKTCL oluşumuna yatkın bireylerde bu kanserin gelişimi engellenemese bile tümör hücreleri vücudun başka bölgelerine yayılmadan erken tanı konularak, tedavi etkinliği ve hasta sağkalım süreleri önemli ölçüde arttırılabilir (6). NKTCL gelişimine genetik yatkınlığa sebep olan SNP’lerin potansiyel klinik uygulamaları Şekil 2’de gösteriliyor.
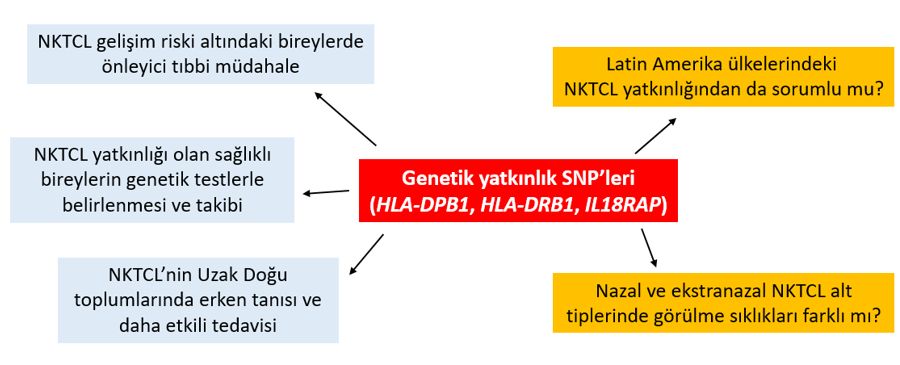
NKTCL, nazal ve ekstranazal olmak üzere iki alt tipe ayrılır, ve bu alt tiplerin klinik agresiflik düzeyleri birbirinden farklıdır. Bu iki alt grup arasında NKTCL yatkınlığıyla ilişkili SNP’lerin gözlenme sıklıkları arasında fark olup olmadığı gelecekte yanıtlanması gereken önemli sorulardan birisi. Yanıtlanması gereken bir diğer önemli soru da bu SNP’lerin Orta ve Güney Amerika ülkelerindeki (Meksika, Peru gibi) yüksek NKTCL gözlemlenme oranından sorumlu olup olmadığı (Şekil 2). Bu bağlamda Latin Amerika ülkelerindeki insanları içeren benzer kapsamlı GWAS çalışmalarına ihtiyaç var.
Sonuç olarak, gerçekleştirilen bu yeni çalışma ile Uzak Doğu insan popülasyonlarında NK/T hücre lenfoması sıklığının genetik kökenlerine yönelik, potansiyel klinik yansımaları da olan önemli bulgular elde edilmiş oldu. Yapılan çalışmanın biyolojik önemi yanı sıra potansiyel klinik yansımalarını tartışan makalemize ulaşmak için tıklayınız.
Can Küçük
Dokuz Eylül Üniversitesi Temel Tıp Bilimleri, Tıbbi Biyoloji AD
İzmir Biyotıp ve Genom Merkezi
BAGEP 2015
Notlar/Kaynaklar:
[1] Kuchenbaecker KB, Hopper JL, Barnes DR, Phillips KA, Mooij TM, Roos-Blom MJ, et al. Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers. Jama. 2017 Jun 20;317(23):2402-16. PubMed PMID: 28632866.
[2] Meijers-Heijboer EJ, Verhoog LC, Brekelmans CT, Seynaeve C, Tilanus-Linthorst MM, Wagner A, et al. Presymptomatic DNA testing and prophylactic surgery in families with a BRCA1 or BRCA2 mutation. Lancet. 2000 Jun 10;355(9220):2015-20. PubMed PMID: 10885351.
[3] Aozasa K, Zaki MA. Epidemiology and pathogenesis of nasal NK/T-cell lymphoma: a mini-review. TheScientificWorldJournal. 2011 Feb 14;11:422-8. PubMed PMID: 21336457. Pubmed Central PMCID: 5720017.
[4] Kucuk C, Jiang B, Hu X, Zhang W, Chan JK, Xiao W, et al. Activating mutations of STAT5B and STAT3 in lymphomas derived from gammadelta-T or NK cells. Nature communications. 2015 Jan 14;6:6025. PubMed PMID: 25586472.
[5] Lin GW, Xu C, Chen K, Huang HQ, Chen J, Song B, et al. Genetic risk of extranodal natural killer T-cell lymphoma: a genome-wide association study in multiple populations. The Lancet Oncology. 2020 Feb;21(2):306-16. PubMed PMID: 31879220.
[6] Kucuk C. Genetic susceptibility to natural killer T-cell lymphoma. The Lancet Oncology. 2020 Feb;21(2):196-7. PubMed PMID: 31879221.