2019 Fizyoloji veya Tıp Nobel Ödülü, “hücrelerin oksijen düzeylerinde meydana gelen değişimleri algılamaları ve düşük oksijen düzeylerine (hipoksi) adaptasyonunu sağlayan mekanizmaları aydınlatıcı buluşları nedeniyle” Amerikalı William G. Kaelin, Gregg L. Semenza ve İngiliz Peter J. Ratcliffe’e verildi. Bu buluşlar yüksek irtifalara hayvanların uyumunu sağlayan temel fizyolojik süreci tanımlamanın ötesinde, araştırmacılara anemi, kanser, kalp hastalığı vb. durumlar için yeni tedavi stratejileri geliştirme yönünde hedefler de sunuyor.
Dr. Kaelin Boston’daki Dana-Farber Kanser Enstitüsü’nde ve Harvard Tıp Fakültesi’nde görev yapıyor. Dr. Semenza, Johns Hopkins Üniversitesi Tıp Fakültesi’nde çocuk hastalıkları, radyasyon onkolojisi ve moleküler radyasyon bilimleri profesörü; Dr. Ratcliffe ise, Londra’daki Francis Crick Enstitüsünde klinik araştırma direktörüdür.
Düşük oksijen düzeylerine vücudun tepkisi
Oksijen, hücresel fonksiyonların sağlıklı bir şekilde devam ettirilmesi için gerekli olan temel moleküldür ve vücutta depolanamadığı için sürekli olarak dış ortamdan alınıp dokulara dağıtılması gerekir. Yeterli oksijenin olmadığı koşullarda beyin, kalp ve böbrekler gibi hayati organlarımız birkaç dakika içinde zarar görmeye başlar. Bu yüzden oksijen azalmasının vücuttaki etkileri birçok araştırmaya konu olmuştur. Vücudumuzun “karotis cisimcikleri” gibi oksijen algılaması için özel dokulara sahip olduğunu biliyoruz. Kanın oksijen düzeyini algılayan özel hücreler içeren karotis cisimcikleri, insan boynunun her iki yanındaki büyük kan damarlarına bitişiktir. 1938 Nobel Fizyoloji veya Tıp Ödülü, karotis cisimcikleri yoluyla kan oksijeninin algılanmasının, doğrudan beynimizle iletişim kurarak solunum hızımızı nasıl kontrol ettiğini gösterdiği keşfi nedeniyle Belçika’lı Corneille Heymans’e verilmişti.
Hipoksik (oksijenin yetersiz olduğu) koşullar altında vücudumuzda değişik adaptasyon mekanizmaları ortaya çıkar:
- Solunum hızı ve kalp debisinde artış,
- Kırmızı kan hücrelerinin (eritrosit) üretiminin artmasına neden olan eritropoietin (EPO) hormonu (böbrek hücrelerinde üretilir) düzeylerinin yükselmesi,
- Yeni damarların oluşumunun artması
- Akciğerlerde difüzyon kapasitesinin (oksijenin akciğerlerdeki havadan kana geçişinin) artması
İnsan vücudundaki tüm hücreler farklı oksijen koşulları altında yaşar ve hücreler oksijen düzeylerindeki değişiklikleri algılayabilir. Bu fonksiyon hücrelerin hipoksik koşullarda yaşamlarını sürdürebilmeleri için önemlidir. Bugün oksijenin düşük düzeylerde olması durumunda, Dr. Semenza’nın hipoksi ile indüklenebilir faktör veya HIF olarak adlandırdığı bir protein kompleksinin vücuttaki tüm hücrelerde artığını biliyoruz. Dokudaki hipoksiyi ortadan kaldırmak için gerekli fizyolojik süreçlerin başlatılmasında görevli olan HIF’deki artışın en önemli etkisi, oksijen taşıyan kırmızı kan hücrelerinin oluşumunu artıran bir hormon olan eritropoietinin (EPO) yapımını düzenleyen genin aktivitesini arttırmak. İşte bu sürecin ve altında yatan moleküler mekanizmaların anlaşılmasında rol alan araştırmacılar Nobel ödülüne layık görüldüler.
Nobel’e giden araştırmalar
Gregg Semenza, yaptığı çalışmalarda EPO geninin farklı oksijen seviyeleriyle nasıl düzenlendiğini inceledi. Genetik yapısı değiştirilmiş fareler kullanarak, EPO geninin yanında bulunan özgül DNA segmentlerinin hipoksiye verilen cevaba aracılık ettiğini gösterdi. Peter Ratcliffe de EPO geninin oksijene bağımlı regülasyonunu inceledi ve her iki araştırma grubu oksijen algılama mekanizmasının sadece böbrek hücrelerinde değil, tüm dokularda mevcut olduğunu buldu.
Dr. Semenza bu yanıta aracılık eden mekanizmayı anlamak için yaptığı detaylı çalışmalarda HIF-protein kompleksini buldu ve devamında HIF kompleksinin saflaştırılması için yoğun çalışmalar başladı. HIF’in iki farklı DNA bağlayıcı protein içerdiği bulundu; bunlar HIF-1α ve ARNT olarak adlandırıldı.
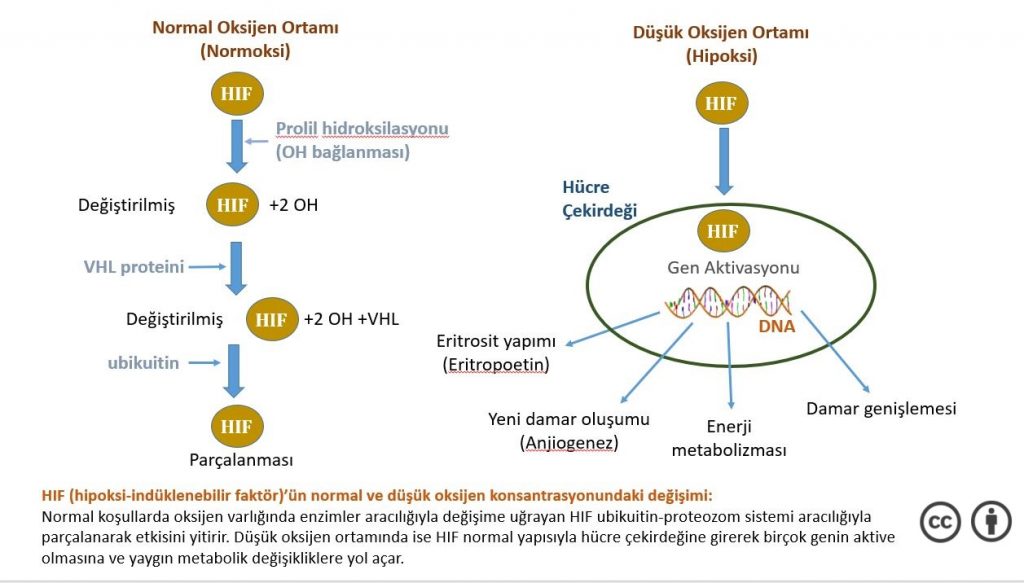
Oksijen düzeyleri, HIF-1α’nın protein stabilizasyonunu, hücre içi yerleşimini ve transkripsiyonunu etkilerken; β (ARNT) alt birimi sürekli aynı düzeyde kalıyor ve oksijen seviyelerinden etkilenmiyor. Oksijen düzeyi yükseldiğinde, hücreler çok az HIF-1α içerirken, oksijen düzeyi düştüğünde HIF-1α’nın miktarı artıyor ve devamında bu kompleks, EPO genine ve HIF bağlayıcı DNA segmentlerine sahip diğer genlere bağlanıyor.
Birçok araştırma grubu HIF-1α’nın normalde hızlıca parçalandığını, hipokside ise parçalanmaya karşı korunduğunu gösterdi. Normal oksijen düzeylerinde, proteazom adı verilen hücresel bir düzenek HIF-1α ‘yı azaltıyor. Bu şartlar altında, HIF-1α proteinine küçük bir peptid olan ubikuitin ekleniyor (ubikuitin aracılı protein yıkımı: 2004 Nobel Kimya ödülü) ve ubikuitin proteazomda parçalanacak proteinler için bir etiket işlevi görüyor. Sonuç olarak etiketlenmiş olan HIF-1α, görevini bitirdikten sonra parçalanarak ortadan kaldırılıyor.
Ubikuitin’in HIF-1α’ya oksijen düzeyindeki değişikliklere göre nasıl bağlandığı sorusunun cevabı, kanser alanında çalışan Dr. William Kaelin’in yaptığı araştırmalarla gösterildi. Dr. Kaelin kanser riskini önemli ölçüde arttıran kalıtsal von Hippel-Lindau (VHL) hastalığı üzerinde çalışıyordu ve VHL geninin kanserin başlamasını önleyen bir proteini kodladığını buldu. Kaelin ayrıca, fonksiyonel VHL geni içermeyen kanser hücrelerinin düşük oksijen düzeyleriyle ilişkili genleri aşırı miktarda ifade ettiğini; ancak kanser hücrelerine VHL geni verildiğinde düşük oksijen düzeyleriyle ilişkili gen ifadesinin normale döndüğünü bildirdi. Bu, VHL’nin bir şekilde hipoksiye verilen yanıtları kontrol altına aldığını gösteren önemli bir ipucuydu.
VHL’yi HIF-1α’ya bağlayan anahtar keşif Dr. Ratcliffe ve araştırma grubu tarafından yapıldı. Grup, VHL’nin fiziksel olarak HIF-1α ile etkileşime girebileceğini ve bu etkileşimin normal oksijen düzeylerinde HIF-1α ’nın parçalanması için gerekli olduğunu gösterdi. Ancak, oksijen düzeylerinin VHL ve HIF-1α arasındaki etkileşimi nasıl düzenlediği konusu eksik kalmıştı. 2001 yılında Dr. Kaelin ve Dr. Ratcliffe’in eş zamanlı yayınladıkları çalışmalarda normal oksijen düzeylerinde, HIF-1α’daki iki spesifik pozisyona hidroksil gruplarının eklendiğini gösterdi (Mircea et al Science, 292, 464-468, 2001; Jakkola et al Science, 292, 468-472, 2001). “Prolil hidroksilasyonu” olarak adlandırılan bu protein modifikasyonu, HIF-1α ile VHL-ubikuitin ligaz kompleksinin etkileşime girmesine ve ubikuitinasyona uğrayan HIF-1α’nın proteozomlar tarafından tanınmasına ve parçalanmasına yol açar. Böylece normal oksijen düzeylerinin oksijene duyarlı enzimler (prolil hidroksilazlar) yardımıyla hızlı HIF-1α yıkımını nasıl kontrol ettiği açıklanmış oldu.
Nobel ödülüne layık görülen bu çığır açıcı çalışmalar sayesinde farklı oksijen düzeylerinin temel fizyolojik süreçleri nasıl düzenlediği hakkında çok daha fazla bilgi elde etmiş durumdayız. Oksijen düzeyinin hassas bir şekilde algılanması; metabolizmamız, bağışıklık sistemimiz ve egzersize uyum gibi çeşitli fizyolojik fonksiyonlarımız için temel öneme sahip. Bunun yanında oksijene bağımlı olarak regülasyonu gerçekleşen HIF, birçok patolojik süreçten de etkileniyor. Anemi, kanser ve diğer hastalıkların tedavisi için oksijenle düzenlenen mekanizmaları duruma göre engelleyebilen ya da aktive edebilen yeni ilaçlar geliştirmek için yoğun çabalar devam ediyor.
Özlem Yalçın
Koç Üniversitesi Tıp Fakültesi, Fizyoloji Anabilim Dalı öğretim üyesi
Kaynak: https://www.nobelprize.org/prizes/medicine/2019/summary/