Eski çağlardan beri maddenin yapısı üzerine düşünen filozoflar maddenin sonsuz derecede küçük parçalara bölünüp bölünemeyeceği üzerine kafa yordular. Her şeyin toprak, su, hava ve ateş gibi her büyüklükte (küçüklükte) var olabilen 4 unsurun çeşitli oranlarda karışımlarıyla oluştuğunu düşünenler etkindi. Antik Yunan uygarlığının altın çağında, MÖ 5. yüzyılda yaşamış Leukippos ve öğrencisi Demokritos, daha sonra Epikuros ve Lukretius maddenin daha fazla bölünemez anlamında a-tomus denen en küçük parçalardan oluştuğunu öne sürdüler.
Deney ve gözleme dayanan modern bilimin gelişmesinden sonra 1803 yılında John Dalton atom fikrini canlandırdı. Dalton, kimyasal reaksiyonlarda her bir maddenin kendine özgü temel bir kütlenin katlarıyla yer aldığına dikkat çekti, buradan bir maddenin atomlarının (veya en küçük birimlerinin, bunlar birkaç atomdan oluşan moleküller de olabilir) belli bir kütlesi olduğunu öne sürdü.
1869 da Dimitri Mendeleev elementleri atom ağırlıklarının yanı sıra kimyasal özelliklerine göre de düzenleyen Periyodik Tabloyu geliştirdi. Bu yıl Periyodik Tablonun 150. Yılını kutluyoruz. Periyodik Tablo temel kimya bilgisini atom fikrini de içeren toplu ve sistematik şekilde sunar. Yine de 20. Yüzyılın başlarına kadar birçok bilim insanı atomların gerçekten var olan nesneler mi yoksa maddenin taşıdığı soyut bir özellik mi olduğunu bilemiyorlardı. Doğrudan doğruya atomların fiziksel varlığını gösteren bir deney ve açıklama ortada yoktu henüz.
Madde birbirinden ayrık parçacıklardan oluşuyor – Brown Hareketi
Atomların somut varlığını gösteren ilk açıklama 1905 yılında* Albert Einstein’dan geldi. Einstein Brown Hareketini çözümleyerek atomların varlığına somut kanıt gösterdi.
Brown hareketi, ilk kez 1827’de botanikçi Robert Brown’ın dikkat çektiği gibi, mikroskop altında gözlenen su içindeki küçük polen (çiçek tozu) parçacıklarının rastgele yönlerde gidip gelmeleri zikzak titreşimlerle suyun içinde gezinmeleridir.
Koshu Endo isimli sanatçının videosunda (13. saniyeden sonra) Brownian hareketi yapan polenleri görüyoruz.
Einstein, suyu oluşturan çok büyük sayıdaki molekülün polen taneciğine oradan buradan farklı hızlarla çarpıp saçılmaları sonucunda poleni böyle rastgele ve titrek biçimde hareket ettirdiklerini düşündü. Buna göre istatistik fizik hesabı yaparak gerçekten de polen taneciğinin hareketinin moleküllerin çarpmalarıyla belirlendiğini gösterdi. Yani su, gözle göremeyeceğimiz boyutta çok sayıda su molekülünden oluşuyordu. Bu hesabın bir yan ürünü olarak her santimetreküp suda kaç molekül olduğunu belirlemiş oldu. Buradan da Avogadro sayısı ölçülüyordu.
Nötr bir atomun iç yapısı nasıl olabilir? – Thomson (üzümlü kek) modeli
Maddenin genellikle elektrik yükü taşımadığı, ancak artı (+) ve eksi (-) diye adlandırılan iki zıt yükün geçici olarak ayrıştırılabildiği ilk çağlardan beri biliniyordu. 1897 yılında J.J. Thomson (-) elektrik yüklerini taşıyan elektron adını verdiği parçacıkları keşfetti. Elementlerin kimyasal özellikleri elektronlarını alıp verebilmelerine göre belirleniyordu. Bir elementin atomlarında Z tane elektron varsa atom yüksüz olduğuna göre Z tane de (+) yük bulunmalı. Bu Z sayısına “atom sayısı” deniyor. (+) ve (-) yükler birbirini çektiğine göre atomun içinde (+) yüklü kısımlarla (-) yüklü elektronlar dağınık olarak bulunmalı. Buna atomun “plum cake” (“erikli kek” – biz Türkiye’de üzümlü keke daha alışığız) modeli deniyor, elektronların oluşturduğu fon (kek) içinde (+) yüklü parçacıkların kekin üzümleri gibi her yana dağılmış olması bekleniyor ki madde net bir elektrik yükü taşımasın.
Üzümlü kekin sonu – Rutherford Deneyi
Rutherford üzümlü kek modelini sınamak üzere bir deney yaptı. İnce bir altın tabakasına hızlandırılmış alfa parçacıkları gönderdi. Alfa parçacıkları aslında Helyum atomunun çekirdeğidir ve 2 proton ve 2 nötrondan oluşurlar, dolayısıyla (+2) elektrik yükü taşırlar. O zamanlar nötron henüz bulunmamıştı ama önemli olan kütlesi ve (+2) yükü belli olan hızlandırılmış alfa parçacıklarının altın tabakasına vurup içinden geçerken nasıl etkilenecekleriydi. Alfa parçacıkları altın atomlarındaki (+) yükler tarafından itilip (-) yükler (elektronlar) tarafından çekilmelerine göre yollarından saparlar.
Bu tipik bir saçılma deneyi: Alfa parçacıklarının kaç tanesi ne kadar açıyla sapıyor buna bakarak altın atomları içinde (+) ve (-) yükler nasıl dağılıyor anlaşılabilir. Hedef olarak altının seçilmiş olması hem altın atomlarının 79 (-) elektron ve 79 (+) proton içerdikleri için saçılma etkilerinin belirgin olacağı beklentisi, hem de altının ince bir tabaka olarak kolay işlenebilmesi. Kek modeline göre üzümler ve kek hamuru her yanda eşit dağılmışsa alfa parçacıkları sağdan soldan yukarıdan aşağıdan aşağı yukarı eşit miktarlarda itilip çekilecekler, sonuç olarak da geliş yönlerinden az sapacaklar. Oysa Rutherford ve ekibi deneyi yaptıklarında alfa parçacıklarının epeyce büyük açılarla saçıldıklarını hatta bazılarının altın tabakasına çarpınca ters yöne geri sektiğini gözlediler.
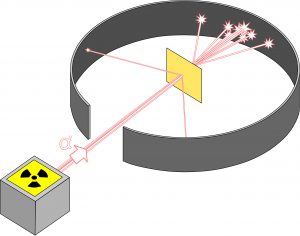
Saçılma açılarının dağılımı çözüldüğünde çok şaşırtıcı beklenmedik bir bilgi çıktı: Her bir altın atomundaki bütün (+) yükler atomun ortasında küçücük bir çekirdek bölgesinde toplanmıştı. Elektronlarsa atomun her tarafına dağılmış olmalıydı. Çekirdeğin yarıçapı atomun yarıçapından 100 000 kere daha küçük, hacmi de atomun hacminden (100 000)3 yani 1015 kere daha küçüktü!
Rutherford çekirdekte bulunan her biri (+) elektron yükü kadar yük taşıyan parçacıklara ‘proton’ adını vermiş. 1932’de James Chadwick tarafından keşfedilen nötron ise yine çekirdekte bulunan, elektrik yükü taşımayan bir parçacık. Proton ve nötronun kütleleri neredeyse birbirine eşit ama elektronun kütlesiyse bundan yaklaşık 2000 kadar daha az. Demek ki atomların neredeyse bütün kütlesi hacmin sadece $10^{15}$’te biri kadar bir yerde toplanmış. Katı ve sıvı hallerde, atomlar birbirine değerken bile maddenin içinde büyük, çok büyük bir kısım azıcık kütle taşıyan bir boşluk.
Bu arada (+) yükleriyle birbirini iten protonları küçücük çekirdek hacmine bağlayıp bir arada tutan, elektrik kuvvetinden çok daha güçlü bir kuvvet de olmalı. Bu yeni temel kuvvet güçlü çekirdek kuvveti olarak adlandırıldı. Çok yakına gelen iki proton, iki nötron, ya da bir proton ile bir nötron birbirlerini güçlü çekirdek kuvveti ile çekip bağlıyorlar.
Rutherford deneyi ile ortaya çıkan atomun yapısı çekirdekte bulunan artı yükler ile çekirdek etrafında bulunan ve çekirdeğe elektrik kuvveti ile çekilen elektronların ayrıştığı bir yapı. Elektronun çekirdekten mesafesine $r$ dersek her bir elektronla çekirdek arasındaki çekici elektrik kuvveti $1/r^2$ ye orantılı. O zaman ortaya çıkan atom modeli klasik fiziğe göre, bir yıldızla etrafındaki bir gezegen, ya da birbirine kütle çekimi kuvveti ile bağlı iki yıldızdan oluşan bir çiftyıldız sistemi ile aynı: çünkü kütle çekimi de iki nesne arasındaki uzaklığa $1/r^2$ gibi bağlı bir kuvvet.
Klasik fiziğe göre kurulan bu atom modeli çalışmadı. Ne atomların tipik büyüklükleri, ne enerjileri, ne de nasıl olup ta dengede kaldıkları anlaşılamıyordu. Klasik fiziğe göre atomlar her boyutta, her enerjide olabilirlerdi, oysa gerçekte durum böyle değildi. Tüm atomların neden birkaç Angstrom (1 Angstrom = $10^{-8}$ cm) yarıçapında ve birkaç elektron-volt enerjide oldukları hiç mi hiç anlaşılamıyordu. Üstelik klasik fiziğe göre çekirdek tarafından çekilerek yörüngede tutulan elektron, ivmeleniyordu ve her ivmelenen yük gibi elektromanyetik dalgalar salarak enerji kaybetmeli ve bu yüzden çok kısa bir süre içinde çekirdeğin içine düşmeli ve böylece atom yok olmalıydı.
Atomların yapıları ve kararlılıkları, ancak elektronların hem parçacık hem de aynı zamanda, dalga oldukları fikriyle açıklanabildi. Danimarkalı fizikçi Niels Bohr’un öne sürdüğü bu yeni atom modeli atomların özelliklerini ve kararlı olmalarını açıklayabiliyordu. Bunu yaparken işin içine yine Planck sabiti giriyordu (bakınız Planck sabiti nedir?). Kuantum Mekaniğine yol açan temel adımlardan biri olan Bohr atom modeli ikinci yazımızda.
Ali Alpar
Bilim Akademisi üyesi
Sabancı Üniversitesi Mühendislik ve Doğa Bilimleri Fakültesi öğretim üyesi
*1905 yılına Albert Einstein’ın Mucize Yılı (Annus Mirabilis) denir. Einstein bu yıl içerisinde Brown hareketi hakkındaki makalesi dışında Özel Görelilik Kuramını geliştirdi, bir önceki yazıda (Planck Sabiti Nedir?) bahsettiğim şekilde fotoelektrik olayını dalgaların parçacık gibi davrandığı yoluyla açıklarken Planck sabitinin de bağımsız bir ölçümüne işaret etmiş oldu.






