Biyomalzemeler insan vücudunda zarar görmüş ya da yetersiz işlev gören doku ve organlara destek olmak ve hatta işlevleri tamamen üstlenmek üzere tasarlanır, üretilir ve uygulanırlar. Nano ve mikrometre boyutunda desenler içeren biyomalzemeler kullanıldığında farklı hücreler bu malzemelere farklı tepki veriyorlar. Bu farklar hem dokuya özgü implant üretiminde çok önemli avantajlar sağlıyor, hem de kanserli hücreleri ayırt etmemize imkan veriyor.
Vücudumuzdaki birçok hücre grubu işlevlerini fiziksel bir yapı içinde yerine getirirler.
Bir implant vücuda yerleştirildiğinde dokuyla etkileşimi büyük önem taşır. Etkileşim moleküler düzeyden daha makroya doğru çeşitli düzeylerde olur. Bu etkileşim sırasında biyomalzeme yüzeyinin fiziksel ve kimyasal özellikleri büyük önem taşır. 2004’ten beri hücrelerin biyomalzeme yüzeyine tutunmaları ve yüzey üzerinde yönlendirilmeleri önemli bir ilgi alanım oldu.
Öncelikle, kornea katmanları, kalp kası ve periferal sinirler gibi tek yönde uzanan hücrelerin oluşturduğu dokuların tedavisinde kullanılabilecek yapay dokuları üretirken hücrelerin üzerine ekileceği biyomalzemelerin yüzeylerini belli kanallar içerecek şekilde üretmeyi planladım. Hücrelerin bu kanallar aracılığıyla yönlendirilmelerinin gelişmekte olan yapay dokunun daha hızlı oluşmasına olanak sağlayacağını düşünmüştüm.
Bu biyomalzemeler, mikroelektronik endüstrisinde (MEMS) çok kullanılan fotolitografi yöntemiyle üretildiler. Çalışmalarda başlangıçta MEMS tekniklerinin izin verdiği ölçüde dar kanallar taşıyan yüzeyler yapıldı. Yapay kornea ve damar çalışmalarımızda bu yönlendirmelerin işe yaradığı ve kanallı filmlerin üzerine ekilmiş hücrelerin çoğalmasına ve mikroçevrelerini üretmesine yardımcı olduğu, sonuç olarak dokunun mekanik dayanıklılığının zamanla arttığı gözlendi [1], [2]. (Şekil 2).
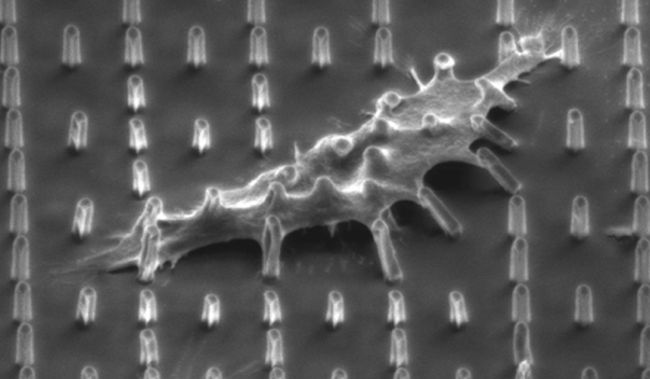
Bu çalışmalar sonrasında çok düşük mikro boyutlarda dikdörtgen prizma şeklinde sütunlar taşıyan yüzeyler yapıldı. Bu yüzeylerde hücrelerin çok belirgin bir biçimde büküldüklerini, mikro yapılara tutunup onları uzantıları (filopodyaları) aracılığıyla kendilerine doğru çektikleri gözlendi (Şekil 1). Bütün bu davranışların hücrelerin yüzeylere tutunması, sayılarının artması (proliferasyon) ve kök hücrelerin farklılaşmaları (diferansiyasyon) etkileri olduğunu sonraki çalışmalarla saptadık.
Bu esnek ve hareketli hücreler fiziksel çevrelerindeki çıkıntı ve çukurları uzantılarıyla sürekli tarıyorlar. Vücudumuzda çok çeşitli tipte hücreler var ve bunların her birinin özellikleri, bu fiziksel uyaranlara karşı verdikleri tepkilerin biçimi ve düzeyi farklılık gösteriyor. Özellikle de kanser hücreleri fiziksel çevredeki bu tasarlanmış çıkıntılara daha belirgin bir tepki verirken, sağlıklı hücreler çevrelerindeki bu fiziksel uyaranlara karşı daha tepkisizler. Bu da doğal olarak kanserli hücrelerin hem kendilerinin hem de çekirdeklerinin esnekliklerinin sağlıklılara oranla daha fazla olduğunu gösteriyor.
Fiziksel desenlerimizin yerleşimleri ve boyutları değiştirildiğinde hücresel tepkilerdeki farkları artırabilmenin de olası olduğunu gözlüyoruz. Bu yöntem özellikle kanserli ve kansersiz hücreleri herhangi bir kimyasal kullanmadan ayırt edebilme olanağı veriyor. Bu da bir doku örneğinde bulunan kanser hücrelerinin varlığını hızla gösterebilen bir tarama sistemi demek.
Aynı yöntemle implantların yüzeylerine hangi hücrelerle temas edeceklerse onların tutunma ve diğer işlevlerini artıracak birer özel tasarım yapma olanağı sağlanmış oluyor. Bu “implanta özgü yüzey” tasarlanabilmesi özelliği biyomalzeme ve doku mühendisliği alanında büyük öneme sahip.
Hücre çekirdeğinin biyomalzemeye tepkisi
Farklı biyomalzemeler üzerinde özellikle hücre çekirdeğinin deforme olması çok önemli bir gözlemdi, çünkü genetik malzeme (DNA) çekirdeğin içinde bulunuyor. Çekirdeğin şeklindeki değişikliklerin DNA’nın ve dolayısıyla hücrenin işlevine etki etmesi söz konusu.
Bu konu çok ilgimizi çekti ve çekirdek deformasyonuyla ilgili kemik kanseri hücrelerini kullanarak yaptığımız ilk araştırmalarımız yayınlandı [3], [4]. Bir yandan bu deformasyonları moleküler düzeyde incelemeye başladık ve deformasyon düzeylerinin sayısallaştırılması yoluyla hücreleri karşılaştırmayı ve sınıflandırmayı planlandık. Böylece sadece bazı hücre çekirdeklerinin şekilleri daha fazla bozuluyor demekten ileriye giderek, şekil bozukluk düzeyini sayılarla ifade edilebilir hale getirmeyi düşündük**.
Mikro sütunlar 4, 8, 16 mikrometre kenarlı ve 8 mikrometre yüksekliğinde dikdörtgen prizma biçiminde üretiliyor ve film yüzeyine satranç tahtası gibi yerleştiriliyor. Bu şekilde 9 değişik film yüzeyi plastikten üretildi. Sütun aralıkları 4-16 mikrometre arasında değişiyordu. Bu yüzeyler önce kemik kanseri hücreleri ile denendi ve görüntülerden hücre çekirdeklerinin şekil deformasyonunu hesaplayacak bir algoritma geliştirildi. Bu 9 yüzeyin hangisinin en fazla şekil değişikliğine sebep olduğu belirlenerek o yüzey daha sonraki çalışmalar için temel ayırıcı yüzey olarak seçildi (Şekil 3).
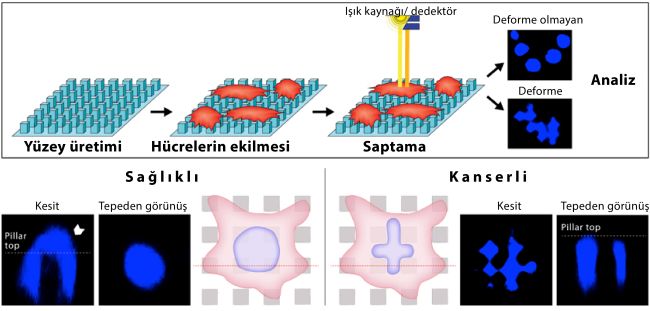
Daha sonra seçilen ayırıcı yüzeye 3’ü farklı kanser türlerinden (kemik, beyin ve meme kanseri), ikisi ise sağlıklı hücre hatlarından (sağlıklı insan kemik hücresi ve bir fibroblast hücresi) hücreler ekildi. Her bir çekirdeğin yüzey alanı, çevre uzunluğu, şekil olarak bir daireye yakınlığı gibi özellikleri ölçüldü. Bunun sonrasında yazılım bu özelliklerin sağlıklı ve kanserli hücreler arasında karşılaştırmasını yaptı (Şekil 4). Sonuçlar elde edildikten sonra ODTÜ Teknokent aracılığıyla patent başvurusu yapıldı ve hemen arkasından 2016 yılında Nature Scientific Reports dergisinde yayınlandı.
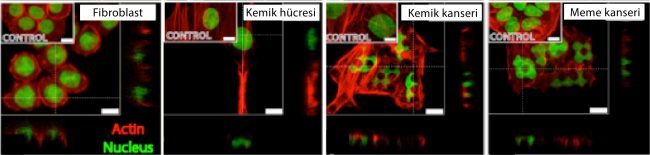
Hücre hatları ile gerçekleştirilen analizden elde edilen verilere göre bu sistemde tek bir hücreye bakıldığında ‘kanserli olduğunu gösterme yeteneği’ %81 ve ‘sağlıklı olduğunu bulma yeteneği’ %72’dir. Çok sayıda hücreden oluşan bir grup kullanıldığında ise bu rakamlar kanserli gruplarda %100 ve sağlıklı gruplarda ise %85 olarak hesaplanmıştır. Bu da özellikle hızlı ve ucuz bir tarama yöntemi olarak kanserli hücreyi yakalamakta hassas bir tanı koyma aracını geliştirmekte başarılı olduğumuzu göstermektedir.
Bu sistemin çalışma yöntemi tarama sırasında bir uzmanın varlığını gerektirmiyor. Yazılım her görüntüden bir puan hesaplıyor ve bu puan da kişiye “kanserli hücre var” ya da “yok” demek için kullanılabiliyor. En basit olanaklara sahip koşullarda bile (birinci seviye sağlık hizmetinin verildiği yerlerin laboratuvarlarında) hastadan alınacak sıvı örneklerde (kan, idrar, balgam, karın içinde biriken sıvı, akciğer sıvısı) ya da hastadan alınan doku (biyopsi) örneklerinde hızlı bir tarama elde edilebilecek.
Hedefimiz sistemi en kısa zamanda gerçek hasta örnekleri ile denemek ve yaygın kullanıma sokabilmek ve bu yönde iki sağlık kuruluşuyla işlemlere başlandı.
Vasıf Hasırcı
Bilim Akademisi üyesi
BIOMATEN, Orta Doğu Teknik Üniversitesi (ODTÜ) Biyomalzeme ve Doku Mühendisliği Merkezi ve ODTÜ FEF Biyolojik Bilimler Bölümü, Ankara
** Bu çalışmada uzun yıllardır tanıştığımız ve bazı öğrencilerimin ortak danışmanı olan Stanford Üniversitesinden (daha önce Harvard Üniv.) Prof. Dr. Utkan Demirci ve birlikte çalıştığı Dr. Derya Akkaynak ile işbirliği yaptık. Dr. Menekşe Ermiş Şen, Sn. Utkan Demirci’yle ortak doktora tez danışmanı olduğumuz bir öğrenci olarak çalışmanın biyolojik aşamalarında olduğu kadar görüntü işlemesinde de yoğun görev yaptı.
[1] N. E. Vrana, A. Elsheikh, N Builles, O.Damour, V.Hasirci, Biomaterials, 2007
[2] P. Zorlutuna, N. Hasirci, V. Hasirci, TERM, 2008
[3] P.M Davidson, H. Özçelik, V. Hasirci, G.Reiter, K.Anselme. (2009). Advanced Materials, 21(35), 3586-3590)
[4] H. Özcelik, C.Padeste, V.Hasirci, Colloids and Surfaces B: Biointerfaces (2014)