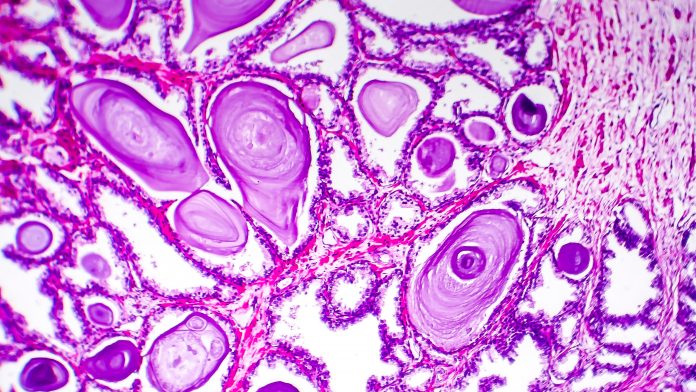
Patoloji, biyopsi, histopatoloji nedir?
Tıpta geleneksel olarak hastalıklara önce tanı konması daha sonra da bu tanıya yönelik tedavilerin uygulanması yaklaşımı benimsenir. Hastalıkları, nedenleri, gelişimleri, hücre, doku ve organlarda oluşturdukları yapısal değişiklerle inceleyen bilim dalına patoloji denir. Patoloji eski dönemlerde yalnızca organlardaki hastalık belirtilerini incelerken mikroskobun keşfiyle doku ve hücrelerin incelenmesi mümkün oldu (histopatoloji).[1]1653’te Petrus Borellus mikroskobun tıpta kullanımıyla ilgili ilk yayını yaptı. Bu yayından yüzyıl sonra mikroskop patologlar tarafından tanı amaçlı kullanılmaya başlandı.(Borellus P. (1653) Historiarum et observationum medico- physicarum centuria. A Colomerium, Castris. Hajdu, S. I. (2002). The first use of the microscope in medicine. Annals of Clinical & Laboratory Science, 32(3), 309-310.) Günümüzde dokulardaki kimyasal (histokimya), immünolojik (immünhistokimya) ve hatta moleküler (moleküler patoloji) değişiklikleri de özel yöntemlerle izleyebiliyoruz.
Patolojik tanı birçok hastalığın tanısında temel veya önde gelen tanı araçlarından birisi. Kanser grubu hastalıklarda hücre veya doku düzeyinde patolojik tanı birçok durumda hastalığın tedavisine başlanılabilmesi için gerekli bir önkoşul. Bunun dışında pek çok organı tutan kanser dışı hastalıkta da doku ve hücrelerden alınan örneklerin patolojik incelemesi tanı için büyük önem taşıyor. Bugün deri, böbrek, karaciğer, tiroid, mide/barsak, prostat, meme, kemik, yumuşak doku, beyin hastalıklarında değişik yöntemlerle alınan hücre ve dokular patoloji laboratuvarlarında incelenerek tanı koyuluyor.
Canlılardan tanı amacıyla alınan hücre ve doku örneklerine biyopsi adı verilir. Bu örnekler, yapılarının incelenebilmesi için öncelikle şekillerini bozulmadan koruyacak (fiksasyon) özel sıvılar içine konulur. En sık kullanılan fiksasyon sıvısı proteinleri pıhtılaştırarak şekil değiştirmelerini önleyen %10’luk formaldehid solüsyonu (formalin)’dir. Daha sonra bu örnekler içlerindeki suyun uzaklaştırılması (susuzlaştırma) ve yerine parafin (balmumu) yerleştirilmesi için bazı işlemlerden geçirilir ve sonra da parafin içinde bloklara yerleştirilir. Bloklar ve içindeki dokulardan ortalama 5 mikron kalınlığında kesitler alınır. Cam lamlara yerleştirilen örnekler boyanır ve mikroskop altında incelemeye hazır hale getirilir (Şekil 1). Bu işlemlerden geçerek parafin bloklar içine gömülü olan örnekler çok uzun yıllar saklanabilir, gerektiğinde immünolojik veya moleküler çalışmalar için de uygun olabilir.
Tanı aşamasında patologlar lamı mikroskop altında değişik mercekler yardımıyla farklı büyüklüklerde incelerler ve hücrelerdeki ya da dokudaki olağandışı değişikliklere ya da bozulmalara göre bir karar verirler. Bu kararda patologlar tanıya yardımcı olacak temel kalıpları ararlar ve zihinlerindeki hastalık modelleriyle bunları eşleştirirler.
Patolojik tanının son yıllarda giderek immünolojik ve moleküler yöntemlerle de desteklenmesine karşın klasik mikroskopik inceleme (histopatoloji) sonuçta bir uzmanın bilgi ve deneyimine dayalı sübjektif bir değerlendirmedir. Nitekim birçok bilimsel çalışma, gerek değişik patoloji uzmanları arasında gerekse de aynı uzmanın zaman içinde aynı örneğe verdiği tanılarda farklılıklar olabileceğini gösteriyor. Bu farklılıklar değişik doku ve hastalık tanıları için farklı oranlarda ortaya çıkabiliyor. İmmünolojik ve moleküler yöntemlerin tanı doğruluğunu sağlamakta katkısı olduğu halde her durumda kullanılamıyor ve kesin tanı çoğunlukla patoloğun kararına bağlı kalıyor. Bu nedenle histopatolojide daha objektif, kriterleri daha sağlıklı uygulayabilen ve giderek öğrenen ve doğruluk oranını arttıran yöntemlere gereksinim olduğu açık.
Şevket Ruacan (Bilim Akademisi üyesi, Hacettepe Tıp Fakültesi emekli öğretim üyesi)
Bu yazıda, ana hatlarıyla sayısal histopatolojiyi ve günümüzde yapay zekâ uygulamalarındaki gelişmelerin bu alana olası katkılarını ele alacağız.
Patolojide sayısal mikroskoplar
Yakın geçmişteki teknolojik gelişmelerden önemli birisi sayısal mikroskopların icadı oldu. Sayısal mikroskop ilk başlarda patologların önceden belirlediği küçük bölgelerin mikroskoplara bağlanmış fotoğraf makineleriyle elde edilen görüntülerinden oluşuyordu. Son yıllarda ise bütün bir lamı (whole slide) kapsayan görüntüler elde edilebiliyor. Bütün lam sayısal mikroskoplar, bir cam lamı şeritler halinde tarayıp bu şeritleri yazılım yardımıyla birleştirerek bütün bir görüntü haline getiriyor. Oluşan görüntüler boyut olarak oldukça büyük; görüntülenen dokunun boyutuna bağlı olarak her bir lam görüntüsü tipik olarak 50.000 x 50.000 pikselden oluşabiliyor. Günümüzde yaklaşık 8 milyon piksel içeren 4K televizyonlar ya da 12 milyon piksel fotoğraflar çeken cep telefonları düşünüldüğünde her biri 2,5 milyar pikselden oluşan bu görüntülerin boyutları dikkat çekici.

Sayısal mikroskoplar pek çok yeni olanak yaratıyor. Örneğin, kolayca kırılabilen cam lamların diğer patologlarla paylaşılabilmesi için dikkatle paketlenip postalanması gerekirken, bu lamların sayısal karşılığı olan görüntüler kolaylıkla başka patolog ve doktorlara internet üzerinden gönderilebilir. Lam görüntüsünün bozulmadan depolanması, arşivlenmesi, indekslenmesi gibi önemli avantajları vardır. Daha önemlisi, bu tür sayısal görüntüler, onlara konulmuş tanılar ve hastalığın uzun vadedeki seyri bilgisiyle eğitilmiş yapay zekâ yardımıyla bilgisayar destekli tanı gerçekleşebilir.
Histopatoloji için yapay zekâ
Sayısal patolojinin en önemli getirilerinden bir tanesi yapay zekâ sistemlerine girdi sağlaması oldu. Öte yandan, bütün lam görüntülerinin bilgisayarla analizi daha önce karşılaşılmayan benzersiz zorluklar ortaya çıkardı. Birinci zorluk, veri miktarı ve içerik karmaşıklığı. İkinci ve daha önemli zorluk ise sayısal patoloji görüntülerinin bilgisayarların altından kalkacağı boyutların kat be kat üstünde olması.
Bir örnek vermek gerekirse görüntü işlemecilerin popüler veritabanı ImageNet yaklaşık 500 x 400 piksel boyutunda 1,2 milyon görüntü içeriyor.[2]Russakovsky, O., Deng, J., Su, H. et al. ImageNet Large Scale Visual Recognition Challenge. (2015) Int J Comput Vis 115, 211–252. Bu kadar çok görüntünün yarattığı toplam veri hacmi yaklaşık 100 adet bütün lam görüntünün piksel hacmine eşit. Bilgisayarların bellek kapasitelerinin sınırı nedeniyle bu büyük lam görüntülerinin işlenebilmeleri için binlerce küçük parçaya bölünmeleri gerekiyor. Bu da görüntü içeriğindeki parça-bütün ilişkisinin kaybolması riskini taşıyor. Bu nedenle yapay zekâ algoritmalarına çok ölçekli analiz yeteneği kazandırmak güncel bir araştırma konusu. Diğer bir deyişle, kaba ölçekte bütün lam görüntüsünün bütününe bakmayı; ölçek inceldikçe daha ayrıntılı ama daha yerel detayları ele alarak parça-bütün ilişkisini korumayı sağlayacak yöntemler araştırılıyor.
Çok büyük patoloji görüntülerinin analizindeki bir başka zorluk da görüntünün hangi bölgelerinin tanı için ilgili ve önemli olduğunun yapay zekâ tarafından baştan bilinmemesi. Yapay zekânın çözmesi beklenen bir problem de şu: Tanı için tüm bölgelere mi bakmalı, yoksa önseziyle aday bölgelere mi odaklanmalı? Tecrübeli patologlar lama düşük büyütmede bakıp hızlıca karar vererek odaklanırlar. Bilgisayarla ise kaba kuvvet bütün görüntüyü incelemektense, hesaplama süresini azaltmak için büyük görüntüdeki ilgisiz bölgeleri elemek, karar aşamasında da sadece önemli detaylara odaklanmak en doğru yol görünüyor.
Önemli bölgelere yoğunlaşan “görsel dikkat modelleri” patologlardan öğreniyor
Nitekim bilgisayarlı tanıda son yıllarda görsel dikkat modelleri büyük ilgi görüyor. Görsel dikkat derken, gereğinde beynimizin neredeyse bütün hücrelerini tek bir noktaya yoğunlaştırıp, çevre teferruatını göz ardı ettiği gibi, algoritmaların da görüntünün tümü yerine hesaplama gücünü küçük bir ilgi noktasına yoğunlaştırmalarını kastediyoruz. Bilgisayarların bütün lamı incelemek yerine belli bölgelere odaklanmasını sağlamak için, örneğin, patologların ekrandaki görüntüleri incelerken kaydedilen yakınlaştırma ya da odaklanma gibi davranışlarına öykünerek farklı büyütmelerde önemli detaylara odaklanabilen yapay derin sinir ağlarını eğitmek mümkün.[3]Gecer, B., Aksoy, S., Mercan, E., Shapiro, L. G., Weaver, D. L., & Elmore, J. G. (2018). Detection and classification of cancer in whole slide breast histopathology images using deep convolutional networks. In Pattern Recognition (Vol. 84, pp. 345–356). Elsevier BV. (Şekil 2).

Öğrenen modeller için önemli kısıtlardan birisi veri eksikliği
Yapay zekâ destekli çalışmaların başarısı iki kritik unsura bağlı. Birincisi, iyi patoloji tanı modelleri. İkincisi, bu binlerce parametre içeren modellerin eğitilmesi için veri, çok veri, çok bol veri. İkinci unsur patoloji görüntüleri için önemli bir kısıt oluşturuyor. Yapay zekâ modellerinin eğitilmesi için internet üzerinde insanların gönüllü etiketlediği (bu bir insandır, bu bir arabadır, bu bir köpektir gibi) görüntülerden farklı olarak çok özel uzmanlık gerektiren patoloji görüntülerinin etiketlenmesi (burası atipik duktal hiperplazidir, burası kolon tümör tomurcuğudur gibi) çok daha zahmetli bir süreç. Etiketleme zorluğu yanında hasta mahremiyeti gibi nedenlerle araştırmacıların büyük ölçekli veriye ulaşması çok zor olabiliyor.
Bu nedenle önce veriye ulaşmanın daha kolay olduğu, mahremiyet gibi kısıtların olmadığı farklı bir problem için model eğitilip sonra daha kısıtlı veriye sahip problem için bu ön-eğitimli model uyarlanmaya çalışılabilir. Bir anlamda, daha elverişli bir problemde öğrendiğimiz genel-geçer bilgileri uzmanlık gerektiren daha özel bir probleme taşıyabiliriz. Nitekim öğrenme transferi gibi yöntemlere patoloji alanında sıklıkla başvuruluyor.
Son yıllarda öne çıkan alternatif bir yaklaşım ise görüntü üzerinde detayların etiketlenmesi yerine sadece lam seviyesinde bir etiket (bu lamda kanser var ya da yok gibi) kullanarak öğrenmeyi amaçlayan zayıf gözetimli öğrenme olarak adlandırılıyor. Zayıf gözetimli öğrenme demek, öğrenme algoritmasına çok daha az sayıda etiketli veri sağlanırken hâlâ başarmasını beklemektir. Bu senaryoda yapay zekâ algoritmaları, hangi görüntü detaylarının benzer şekilde etiketlenen lamlarda tutarlı bir şekilde ortaya çıktığı sorusuna cevap bulmaya çalışıyor (Şekil 3).
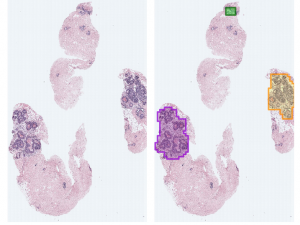
Sadece lam seviyesinde etiketlenmiş çok sayıda görüntü ile oluşturulan modeller, detayları işaretlenmiş az sayıda görüntü ile oluşturulan modellere kıyasla daha tatmin edici sonuçlara ulaşabiliyor ve dolayısıyla bu yöntemler gelecek vadediyor.[4]Campanella, G., Hanna, M.G., Geneslaw, L., Miraflor, A., Silva, V.W.K., Busam, K.J., Brogi, E., Reuter, V.E., Klimstra, D.S., Fuchs, T.J., (2019) Clinical-grade computational pathology using weakly supervised deep learning on whole slide images. Nat. Med. 25 (8), 1301-1309.
Klinik tanı için yapay zekâ
Derin öğrenme alanındaki yenilikler, birçok yapay zekâ uygulamasında olduğu gibi histopatolojide de bir milat noktası olarak değerlendirilebilir.[5]Srinidhi, C. L., Ciga, O., & Martel, A. L. (2021). Deep neural network models for computational histopathology: A survey. In Medical Image Analysis (Vol. 67, p. 101813). Elsevier BV. Mevcut durumda eğitilen parametrelerin çokluğu ve elde edilen modelin girdileri ile çıktıları arasındaki dönüşümü sağlayan fonksiyonun karmaşıklığı nedeniyle çoğunlukla kara kutu olarak nitelenen bu derin ağ yapılarının yaygın klinik kullanıma ulaşabilmesi için bu modellerin ne öğrendiklerinin anlaşılabilmesi ve verdikleri sonuçların yorumlanabilir hale getirilebilmesi gerekiyor. Açıklanabilir derin öğrenme alanındaki çalışmalara örnek olarak, derin ağların görüntünün hangi detaylarını varılan tanı açısından önemli bulduğuna dair görselleştirme yöntemleri verilebilir.
Sayısallaştırılmış lam görüntüleri ile cam lamlar kullanılarak erişilen sonuçlar tutarlı mı? Bir yanda biyopsi örnekleri cam lamlar ile mikroskop altında yorumlanıyor; bir yanda sayısallaştırılmış lamlar bilgisayar ekranında inceleniyor. Japonya’da yapılan bir araştırmada dokuz farklı hastaneden alınmış farklı organlara ait 900 biyopsi örneğinden çekilen toplam 1070 bütün lam görüntünün dokuz farklı patolog tarafından değerlendirilmesi sonucunda görüntülerin %96’sı için varılan teşhislerin cam lamlar kullanılarak elde edilen teşhislerle uyumlu olduğu ortaya konmuş.[6]Tabata, K., Mori, I., Sasaki, T., Itoh, T., Shiraishi, T., Yoshimi, N., Maeda, I., Harada, O., Taniyama, K., Taniyama, D., Watanabe, M., Mikami, Y., Sato, S., Kashima, Y., Fujimura, S., & Fukuoka, J. (2017). Whole-slide imaging at primary pathological diagnosis: Validation of whole-slide imaging-based primary pathological diagnosis at twelve Japanese academic institutes. In Pathology International (Vol. 67, Issue 11, pp. 547–554). Wiley. Meme kanseri patolojisine odaklanan ve 200’den fazla patoloğun katıldığı bir başka çalışmada ise, iyi huylu ve invaziv (istilacı) örneklerde cam ve sayısal lamların incelenmesi arasında bir fark gözükmezken doku değişimindeki çeşitliliğin daha fazla olduğu atipik hiperplazi ve in situ karsinom sınıflarında ise %5 civarında uyumsuzluklar gözlenmiş, daha fazla klinik çalışma yapılmasının gerekliliği üzerinde durulmuş.[7]Elmore, J., Longton, G., Pepe, M., Carney, P., Nelson, H., Allison, K., Geller, B., Onega, T., Tosteson, AnnaN. A., Mercan, E., Shapiro, L., Brunyé, T., Morgan, T., & Weaver, D. (2017). A randomized study comparing digital imaging to traditional glass slide microscopy for breast biopsy and cancer diagnosis. In Journal of Pathology Informatics (Vol. 8, Issue 1, p. 12). Medknow. Sayısal patoloji sistemlerinin resmi onay almaya başlamalarıyla birlikte klinik tanı için kullanımlarının da yaygınlaşması bekleniyor.
Patoloji eğitimi ve kalite güvencesi
Yapay zekâ destekli sayısal patolojinin katkı yaptığı bir başka alan da uzman eğitimi. Bütün lam tarayıcılardan alınan görüntüler halihazırda konferanslarda, çalıştaylarda ve tümör konseyi gibi toplantılarda kullanılıyor. Bu görüntülerin yaygınlaşmasıyla birlikte, yapay zekâdan yeni nesil patologların eğitimi konusunda da ihtiyaca özel, kontrollü ve etkileşimli bir eğitim programı kurgulanmasında yararlanılabilir. Son yıllarda teknolojideki gelişmelere paralel olarak yapay görüntü oluşturma yöntemleri de sayısal patolojide yer bulmaya başladı. Örneğin, çekişmeli üretici sinir ağları kullanılarak elde edilen yapay görüntüler, patolog adaylarının eğitiminde kontrollü bir şekilde örnekler oluşturma konusunda beklenen başarıya her geçen gün daha da yaklaşıyor.[8]Tschuchnig, M. E., Oostingh, G. J., & Gadermayr, M. (2020). Generative Adversarial Networks in Digital Pathology: A Survey on Trends and Future Potential. In Patterns (Vol. 1, Issue 6, p. 100089). Elsevier BV
Yapay zekânın diğer klinik verilerle bütünleştirilmesi
Bilgisayar yardımıyla tıbbi görüntülerin analizinin mevcut tanı yöntemleriyle bütünleştirilmesi, tanıların doğruluğunu ve tutarlılığını artırma potansiyeline sahip. Bir tümörün histolojik özelliklerini tutarlı ve güvenilir bir şekilde hesaplamak, hastalığın tanısal sınıflandırmasında uzman patologlara destek sağlıyor. Görüntü analizi, dokuyu nicel bir şekilde tanımlamak için matematiksel bir model sunmakta. Oysaki patologların dokuları sadece mikroskop kullanarak nicel olarak analiz etmeleri mümkün değil. Buna karşılık, patologlar, verdikleri kararların nedenlerini açıklama konusunda yapay zekâ yöntemlerine göre daha güçlüler. Patologların zayıf oldukları nokta ise tanıların tutarlılığı. Farklı patologlar aynı görüntü için farklı teşhis koyabiliyor veya aynı patolog farklı zamanlarda aynı resme farklı teşhis koyabiliyor. Yapay zekâ yöntemlerinde ise bu durum görülmez: belirli bir yapay zekâ modeli eğitilmesini tamamladıktan sonra aynı resim için hep aynı cevabı (tanı) verir. Yeni yapay zekâ uygulamaları eksik oldukları konuda (yani vardığı kararı açıklamaya dönük) geliştiriliyor.
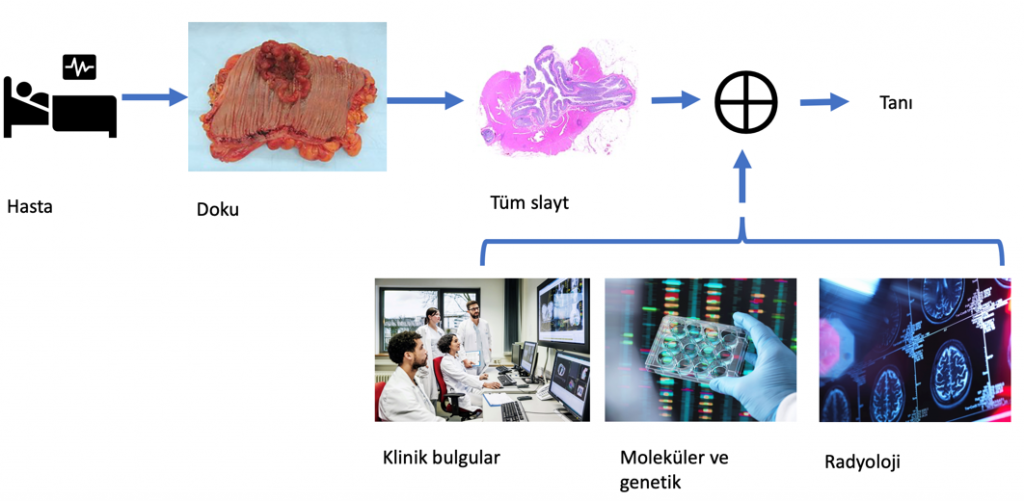
Histopatolojik görüntü analizi, yapay zekâ kullanarak klinik kayıtlardan ve hasta demografik bilgilerinden gelen diğer bazı veri kaynakları kullanılarak daha doğru ve daha güvenilir hale getirilebilir (Şekil 4). Klinik veriler (ör. demografik bilgiler, tıbbi geçmiş, laboratuvar ve klinik sonuçlar) çoğunlukla yapılandırılmamış, serbest metin raporlarında bulunuyor. Doğal dil işleme teknolojileri, ilgili bilgileri çıkarmak ve bunları lamlardaki bilgilerle ilişkilendirmek için kullanılıyor. Yapay zekâ, bu farklı bilgi kaynaklarını tarayarak patologların hastalar için en iyi klinik kararlara ulaşmalarına yardımcı olabilir. Aynı zamanda, belirli bir hasta için daha karmaşık veya daha ayrıntılı ilişkileri keşfedebilir. Zengin veri kaynakları patolojiyi, klinik bilimden dokunun veri kaynaklarından yalnızca biri olduğu bilişim bilimine dönüştürüyor.
Yapay zekâ ile ilgili zorluklar: Yapay zekâ patologların yerini alacak mı?
Histolojide derin öğrenme modellerinin yorumlanabilmesi için görselleştirme konusundaki çalışmalar devam ediyor. Dahası, modelleri bir patoloğun anlayabileceği şekilde histolojik bulguların doğal dil tanımlarına dayalı tanı raporları oluşturmayı öğrenen algoritmalar da var. Patoloji görüntüleri ve klinik raporlar üzerinde eğitilen bu modeller, aynı anda rutin klinik histopatoloji uygulamalarında fikir birliğini teşvik ederken, güvenilir tanı, güçlü genelleştirilebilirlik ve nesnel ikinci görüşler sunma potansiyeline sahip.
Yapay zekânın patologların yerini alacağı fikri şu an sadece bir spekülasyon ama gerçek olan yapay zekânın patologlara son derece yardımcı olabileceği. Uzman-yapay zekâ birlikteliği, bir uzmanın tek başına yapabileceğinden daha doğru, tutarlı ve faydalı sonuçlar verebilecek.
Yapay zekâ dar alanlarda kararlar almaya devam ederken, insanlar birkaç faktörü hesaba katabiliyor ve kararlara varmak için bilgileri sentezlemede daha iyiler. Yapay zekâ, bilgi özütleme (information extraction) ve diğer tamamlayıcı bilgi kaynakları ile bağlantı kurmak için eğitilebilir. Örneğin, hesaplamalı histolojik analiz ve kötü huylu tümör lamlarında vücut sıvısındaki protein türlerinin dağılımı kullanılarak farklı hastaların tümörlerinden alınan farklı bölümler birlikte değerlendirebilir.[9]Niazi, M. K. K., Chung, J. H., Heaton-Johnson, K. J., Martinez, D., Castellanos, R., Irwin, M. S., Master, S. R., Pawel, B. R., Gurcan, M. N., & Weiser, D. A. (2017). Advancing Clinicopathologic Diagnosis of High-risk Neuroblastoma Using Computerized Image Analysis and Proteomic Profiling. In Pediatric and Developmental Pathology (Vol. 20, Issue 5, pp. 394–402). SAGE Bu çalışma, tümör içi heterojenliğin, tümörler arası heterojenlikten daha yüksek olduğunu belirlediği ve her iki tekniğin birleştirilmesinin patolog incelemesini destekleyebileceğini gösterdiği için önemli.
Farklı doktorların aynı protokolü takip edip farklı sonuçlara ulaşabildiği gibi, farklı yapay zekâ platformlarının da farklı sonuçlara yol açabileceğini akılda tutmak önemli. Düzenleyici kontrole kesinlikle ihtiyaç duyulsa da (yani, bu yöntemlerin ve cihazların güvenli ve etkili olduğunun gösterilmesi gerekiyor), belirli bir sorunu çözmek için hâlâ birden fazla yöntem olabilir.
Yapay zekâ alanındaki bazı heyecan verici gelişmeler tıbba henüz tamamıyla uygulanmadı. Burada detayına girmeyeceğimiz tek aşamalı öğrenme, takviyeli öğrenme gibi yöntemler patolojide karmaşık kararlar almak için yeni algoritmaların eğitilmesinde yararlı olabilir. Bilişim altyapılarının güçlendirilmesi ve diğer yazılımlarla entegrasyonu ile birlikte zaman içinde bütün tanıların sayısal ortamda yapılacağını bekleyebiliriz.[10]Patterson, E., Rayo, M., Gill, C., & Gurcan, M. (2011). Barriers and facilitators to adoption of soft copy interpretation from the user perspective: Lessons learned from filmless radiology for slideless pathology. In Journal of Pathology Informatics (Vol. 2, Issue 1, p. 1). Medknow.
Selim Aksoy (Bilkent Üniversitesi, Bilgisayar Mühendisliği Bölümü)
Metin Nafi Gürcan (Wake Forest Üniversitesi, Tıp Fakültesi, Biyomedikal Bilişim Merkezi)
Daha fazla bilgi edinmek için:
Orijinal olarak radyolojide bilgisayar destekli tanı için geliştirilen algoritmaların çoğu, sayısal patolojide kullanılmak üzere başarıyla uyarlanmıştır.
Derin öğrenme yöntemlerinin yaygın bir şekilde benimsenmesinden önce gerçekleştirilen çalışmaların kapsamlı incelemeleri [11]Gurcan, M. N., Boucheron, L. E., Can, A., Madabhushi, A., Rajpoot, N. M., & Yener, B. (2009). Histopathological Image Analysis: A Review. In IEEE Reviews in Biomedical Engineering (Vol. 2, pp. 147–171). Institute of Electrical and Electronics Engineers (IEEE). ve [12]Madabhushi, A., & Lee, G. (2016). Image analysis and machine learning in digital pathology: Challenges and opportunities. In Medical Image Analysis (Vol. 33, pp. 170–175). Elsevier BV.’de, derin öğrenme tabanlı yöntemlerin kapsamlı incelemeleri ise [13]Janowczyk, A., & Madabhushi, A. (2016). Deep learning for digital pathology image analysis: A comprehensive tutorial with selected use cases. In Journal of Pathology Informatics (Vol. 7, Issue 1, p. 29). Medknow. ve [14]Srinidhi, C. L., Ciga, O., & Martel, A. L. (2021). Deep neural network models for computational histopathology: A survey. In Medical Image Analysis (Vol. 67, p. 101813). Elsevier BV.’de bulunabilir.
 Bu eser görseller hariç Creative Commons Atıf-GayriTicari 4.0 Uluslararası Lisansı ile lisanslanmıştır. İçerik kullanım koşulları için tıklayınız.
Bu eser görseller hariç Creative Commons Atıf-GayriTicari 4.0 Uluslararası Lisansı ile lisanslanmıştır. İçerik kullanım koşulları için tıklayınız.
Notlar/Kaynaklar
| ↑1 | 1653’te Petrus Borellus mikroskobun tıpta kullanımıyla ilgili ilk yayını yaptı. Bu yayından yüzyıl sonra mikroskop patologlar tarafından tanı amaçlı kullanılmaya başlandı.(Borellus P. (1653) Historiarum et observationum medico- physicarum centuria. A Colomerium, Castris. Hajdu, S. I. (2002). The first use of the microscope in medicine. Annals of Clinical & Laboratory Science, 32(3), 309-310.) |
|---|---|
| ↑2 | Russakovsky, O., Deng, J., Su, H. et al. ImageNet Large Scale Visual Recognition Challenge. (2015) Int J Comput Vis 115, 211–252. |
| ↑3 | Gecer, B., Aksoy, S., Mercan, E., Shapiro, L. G., Weaver, D. L., & Elmore, J. G. (2018). Detection and classification of cancer in whole slide breast histopathology images using deep convolutional networks. In Pattern Recognition (Vol. 84, pp. 345–356). Elsevier BV. |
| ↑4 | Campanella, G., Hanna, M.G., Geneslaw, L., Miraflor, A., Silva, V.W.K., Busam, K.J., Brogi, E., Reuter, V.E., Klimstra, D.S., Fuchs, T.J., (2019) Clinical-grade computational pathology using weakly supervised deep learning on whole slide images. Nat. Med. 25 (8), 1301-1309. |
| ↑5, ↑14 | Srinidhi, C. L., Ciga, O., & Martel, A. L. (2021). Deep neural network models for computational histopathology: A survey. In Medical Image Analysis (Vol. 67, p. 101813). Elsevier BV. |
| ↑6 | Tabata, K., Mori, I., Sasaki, T., Itoh, T., Shiraishi, T., Yoshimi, N., Maeda, I., Harada, O., Taniyama, K., Taniyama, D., Watanabe, M., Mikami, Y., Sato, S., Kashima, Y., Fujimura, S., & Fukuoka, J. (2017). Whole-slide imaging at primary pathological diagnosis: Validation of whole-slide imaging-based primary pathological diagnosis at twelve Japanese academic institutes. In Pathology International (Vol. 67, Issue 11, pp. 547–554). Wiley. |
| ↑7 | Elmore, J., Longton, G., Pepe, M., Carney, P., Nelson, H., Allison, K., Geller, B., Onega, T., Tosteson, AnnaN. A., Mercan, E., Shapiro, L., Brunyé, T., Morgan, T., & Weaver, D. (2017). A randomized study comparing digital imaging to traditional glass slide microscopy for breast biopsy and cancer diagnosis. In Journal of Pathology Informatics (Vol. 8, Issue 1, p. 12). Medknow. |
| ↑8 | Tschuchnig, M. E., Oostingh, G. J., & Gadermayr, M. (2020). Generative Adversarial Networks in Digital Pathology: A Survey on Trends and Future Potential. In Patterns (Vol. 1, Issue 6, p. 100089). Elsevier BV |
| ↑9 | Niazi, M. K. K., Chung, J. H., Heaton-Johnson, K. J., Martinez, D., Castellanos, R., Irwin, M. S., Master, S. R., Pawel, B. R., Gurcan, M. N., & Weiser, D. A. (2017). Advancing Clinicopathologic Diagnosis of High-risk Neuroblastoma Using Computerized Image Analysis and Proteomic Profiling. In Pediatric and Developmental Pathology (Vol. 20, Issue 5, pp. 394–402). SAGE |
| ↑10 | Patterson, E., Rayo, M., Gill, C., & Gurcan, M. (2011). Barriers and facilitators to adoption of soft copy interpretation from the user perspective: Lessons learned from filmless radiology for slideless pathology. In Journal of Pathology Informatics (Vol. 2, Issue 1, p. 1). Medknow. |
| ↑11 | Gurcan, M. N., Boucheron, L. E., Can, A., Madabhushi, A., Rajpoot, N. M., & Yener, B. (2009). Histopathological Image Analysis: A Review. In IEEE Reviews in Biomedical Engineering (Vol. 2, pp. 147–171). Institute of Electrical and Electronics Engineers (IEEE). |
| ↑12 | Madabhushi, A., & Lee, G. (2016). Image analysis and machine learning in digital pathology: Challenges and opportunities. In Medical Image Analysis (Vol. 33, pp. 170–175). Elsevier BV. |
| ↑13 | Janowczyk, A., & Madabhushi, A. (2016). Deep learning for digital pathology image analysis: A comprehensive tutorial with selected use cases. In Journal of Pathology Informatics (Vol. 7, Issue 1, p. 29). Medknow. |