COVID-19 salgınının bütün dünyayı etkilediği günümüzde bu salgının tıbbi, ekonomik, sosyal, psikolojik boyutları ve sonuçları her yönüyle tartışılıyor, uzmanlar görüşlerini kamuoyuyla paylaşıyor.
Ne var ki, belki de pek gündeme gelmeyen, üzerinde konuşulmayan kısım, hastalığa karşı geliştirilecek aşının geniş halk kitlelerine nasıl ulaştırılacağı. Şüphesiz bu konuda yapılacak organizasyon ve aşılama sürecinin yönetimi halk sağlığı uzmanlarının alanına giriyor.
Bu yazının konusu ise toplumun aşıya ulaşmasında karşılaşılabilecek hukuki engeller. Hukuki engellerden kastettiğimiz, geliştirilen aşı üzerinde söz konusu olabilecek patent hakları ile aşının üretilip kullanılması için gereken ruhsatlar. Şüphesiz bu kısa yazıda her biri tek başına derin inceleme ve değerlendirmeyi gerektiren bu konuları bütün yönleriyle ele alabilmek mümkün değil, dolayısıyla bu meseleyi sadece COVID-19 salgını ile bağlantılı taraflarıyla sınırlı olarak ele alacağız.
Bu bağlamda ilk akla gelen sorular şöyle sıralanabilir:
- COVID-19 aşısı bulunduğunda, geliştirilen aşı için patent alınabilir mi?
- Örneğin Amerikalı bir ilaç şirketi COVID-19 aşısı bulursa nereden patent alacaktır? Alacağı patent ile ne gibi haklara sahip olacaktır?
- Kore’de bir başka şirket de bu arada COVID-19’a karşı bir aşı geliştirirse bunun için patent alabilir mi?
- Bu patentler karşısında örneğin Türkiye’deki hastaların aşıya erişimi nasıl sağlanacak?
- Türkiye’de Sağlık Bakanlığı bu aşıyı/aşıları üretebilecek ya da ürettirebilecek mi?
- Aşının aşırı pahalı olması durumunda insanlar/devletler buna nasıl erişebilecek?
Bütün bu soruları ele aldıktan sonra sonuç bölümünde ise sistem, kurallar ve istisnalar dikkate alınınca olası bir aşı bulunduğunda buluş sahibinin nasıl davranacağını tahmin etmeye çalışacağız.
Patent Sistemi ve TRIPS Antlaşması
Patent sisteminin amacı teknoloji alanındaki yenilikleri ödüllendirerek buluş sahiplerinin daha fazla buluş yapmaya ve bunun bilgisini toplumla paylaşmaya teşvik etmektir. Patent buluş sahibine başvuru tarihinden itibaren 20 yıllık bir koruma sağlar. Bu da patent sahibinin izni olmadan, anılan süre boyunca, hiç kimsenin buluşu üretememesi, satamaması, kullanamaması ve ithal edememesi anlamına gelir. 20 yıllık koruma süresi sonunda ise buluş, herhangi bir izne gerek olmaksızın toplumun serbest kullanımına açılır.
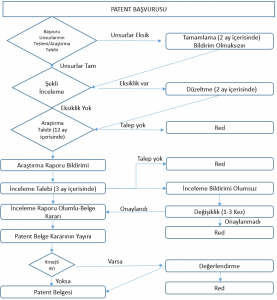
Patent alabilmek için buluş sahibinin buluşunu açıklayan bir başvuru yapması, başvuruyu inceleyen otoritenin de buluşun yenilik ve aşikâr olmama gibi şartları taşıdığına karar vererek bunu tescil etmesi gerekir.
Patent verilmesi süreci 2-3 yıl alabilir. Ancak koruma başvuru tarihinden itibaren başladığı için, sonunda patent alınması şartıyla bu sürecin uzunluğunun kural olarak bir önemi bulunmaz.
Bu noktada önemle altının çizilmesi gereken husus dünya patenti diye bir şeyin olmadığı. Bir diğer deyişle buluş sahibi alacağı tek bir patent ile buluşunu bütün dünyada koruyamaz. Uluslararası patent sistemi, farklı ülkelerde yapılacak başvuruları kolaylaştırmak ve ülkelerin mevzuatı arasında uyum sağlamak amacına hizmet eder. Böylelikle patent sahibi diğer ülkelerde elde edeceği koruma konusunda sürprizlerle karşılaşmamış olur.
Günün sonunda, buluş hangi ülkede korunmak isteniyorsa o ülkede patent alınması gerekir. Patent sahibinin tescil almadığı ülkelerde buluşunun üretilmesini, satılmasını ya da kullanılmasını engelleme hakkı bulunmaz. Bu nedenle özellikle dünya çapında korumaya değer buluşların sahipleri birden fazla ülkede patent tescili almaya çalışırlar. Bunu da ya kendi ülkelerinde yaptıkları başvurunun önceliğinin diğer ülkelerde de tanınmasını sağlayarak onlara o ülkelerde de başvuru yapma hakkı tanıyan ya da başvuru sürecini uluslararası bir kuruluş aracılığıyla sürdürmelerini sağlayan uluslararası sözleşmeler aracılığıyla gerçekleştirirler.
Uluslararası patent sisteminde söz konusu öncelik, “rüçhan hakkı” adı altında Paris Antlaşması adı verilen 1883 tarihli uluslararası sözleşme ile kabul ediliyor. Buna göre Paris Antlaşması’na üye olan ülkelerden herhangi birisinde yapılan bir patent başvurusu, başvuru tarihinden itibaren 12 ay içinde diğer ülkelerde de yapılırsa ilk başvurunun önceliği korunmuş oluyor. Buluşun yapıldığı tarihten bağımsız olarak patentin ilk başvuru yapana verilecek olması ilkesi (first to file principle) bütün dünyada kabul ediliyor. Bu nedenle, başvurunun yapıldığı tarih büyük önem taşıyor. Bahsi geçen 12 ay içinde, diğer ülkelerde yapılacak bir başka başvuru ilk ülkedeki öncelikli başvuru nedeniyle reddediliyor. Bu sistemde başvuruların, bahsedilen süre içinde, buluşun korunmak istendiği her ülkede ayrı ayrı yapılması gerekiyor[2]. Başvuru sahibine önemli bir avantaj tanımasına rağmen, her ülkede ayrı başvuru yapma zorunluluğu ve her başvuru ayrı kabul edildiğinden her ülkede işlemlerin en baştan tekrar yapılması gerekliliği maliyeti arttırıyor.
Her ülkede ayrı başvuru yaparak bütün işlemlerin yeniden yapılması zorunluluğunu ortadan kaldırmak için 1970 yılında Patent İşbirliği Antlaşması (Patent Cooperation Treaty –PCT ) imzalandı. Bu Antlaşma uyarınca uluslararası bir kuruluş olan WIPO’ya (Dünya Fikri Mülkiyet Örgütü) yapılacak olan bir uluslararası patent başvurusu sayesinde tek bir başvuru ile bütün üye ülkelerde patent başvurusu yapılmış kabul ediliyor [3]. Ancak PCT ile sadece başvuru aşamasındaki işlemler tek elden yürütülüyor. Başvuru sürecinin bir aşamasında başvuru sahibinin yine de patentini korumak istediği ülkeye giriş yapması, o ülkenin yetkili makamlarıyla muhatap olması ve patentini orada tescil ettirmesi gerekiyor. Başvuruyu tescil kararı ilgili ülke tarafından veriliyor.
Ülkelerin patent mevzuatında uyum sağlamak için kabul edilen en önemli uluslararası anlaşmalardan bir tanesi TRIPS (Trade Related Intellectual Property Rights– Ticaretle Bağlantılı Fikri Mülkiyet Hakları) Antlaşması’dır[4].
1995 yılında yürürlüğe giren bu Antlaşma, Dünya Ticaret Örgütü’nü kuran Antlaşmanın eki niteliğinde olup üye devletler tarafından kabul edilmek ve uygulanmak zorundadır. TRIPS anlaşmasında sadece patentler değil, telif hakları, markalar, coğrafi işaretler ve tasarımlar gibi diğer fikri mülkiyet hakları da düzenlenmiştir. Patentler ile de ilgili olarak bunların koruma şartları, sahibine verdiği haklar ve üçüncü kişiler lehine olarak bu haklara getirilen sınırlamalara yer verilmiştir. Görüldüğü üzere TRIPS Antlaşması yukarıda bahsedilen ve patent başvuru sürecine ilişkin usul kuralları getiren Paris Antlaşması ve PCT’den farklı olarak hakkın içeriğine ilişkin olan konuları düzenlemiştir. TRIPS Antlaşmasına taraf olan ülkeler kanunlarını bu Antlaşmada yapılmış olan düzenlemelere uydurmak zorundadır. Anlaşmada yer alan düzenlemeler asgari standartları ifade eder ve devletler arzu ederlerse hak sahiplerine daha geniş haklar tanıyabilirler.
TRIPS Antlaşması teknolojinin her alanındaki buluşların patent verilerek nasıl korunacağını düzenliyor. Buna göre alan ve sektör farkı olmaksızın, tıp alanı da dahil olmak üzere bütün buluşlar için patent koruması söz konusu. Bir üye devletin patent kanununda buna aykırı düzenleme yapması ya da uygulamalarda bulunması mümkün değil.
TRIPS Antlaşması, üye devletlerin bazı buluşları patent koruması dışında tutabilmesine imkân tanıyor. Bunlar arasında insanlar ve hayvanlar üzerinde teşhis, tedavi ve cerrahi yöntemler de bulunuyor[5]. Fakat bu istisnaların dışında tıp alanındaki diğer buluşların patent verilebilirlik dışında bırakılabilmesine izin verilmiyor. Buna göre TRIPS üyesi ülkeler tıbbi cihazlar, ilaçlar ve aşılar için patent koruması tanımak zorunda. Nitekim günümüzde ilaç sektörü patent korumasının en yaygın ve en agresif şekilde kullanıldığı alanlar arasında yer alıyor. Sonuç olarak TRIPS Antlaşmasına üye olan bir devletin COVID-19 için geliştirilmiş aşıya patent vermeme lüksü bulunmuyor.
Patentler buluşu, yani probleme getirilen teknik çözümü korur. Aynı çözümü farklı kişilerin birbirinden bağımsız olarak bulmuş olmaları imkânsız değildir. Ancak yukarıda da belirtildiği gibi patent ilk başvuru yapana verildiği için, aynı buluş için başvuruyu ilk yapan kişi, uluslararası patent sistemini kullanarak diğer ülkelerde de bu buluşunu patentle koruyabilir. Aynı problemin farklı şekillerde çözülmüş olması da mümkün. Korunan şey çözüm olduğu için, aynı probleme dair farklı çözümler ayrı ayrı patentlenebilir. Dolayısıyla pek çok ülkede COVID-19 virüsüne karşı eş zamanlı olarak yürütülen çabalar sonucunda farklı kimyasal bileşiklere sahip birden fazla aşı geliştirilmişse, ortada birden fazla buluş olacağı için bunları hepsi ayrı ayrı patentlere konu olabilir.
Patent veri tabanlarında yaptığımız yüzeysel bir Dolayısıyla pek çok ülkede COVID-19 virüsüne karşı eş zamanlı olarak yürütülen çabalar sonucunda farklı kimyasal bileşiklere sahip birden fazla aşı geliştirilmişse, ortada birden fazla buluş olacağı için bunları hepsi ayrı ayrı patentlere konu olabilir.araştırmada COVID-19 virüsü ile ilgili 5 Mart 2020 tarihli bir Kore patent başvurusunun yapıldığını görüyoruz. Bu başvuruyu yayınlanmış olduğu için tespit edebiliyoruz. Kore’de ya da farklı ülkelerde henüz yayınlanmamış olan başka patent başvurularının da bulunduğunu söylemek yanlış olmaz. Yakın zamanda COVID-19 aşısını konu alan pek çok patent başvurusunun yayınlanmasını bekleyebiliriz. Nitekim sadece “coronavirus” anahtar kelimesi ile yapılan bir araştırma en eskisi 1972 tarihli olan 170 civarında patent başvurusu/patent gösteriyor.
Covid-19 aşısının patentlenmesi halinde aşıya nasıl erişilebilir?
Aşının pazara sunulabilmesi için gereken onay süreci
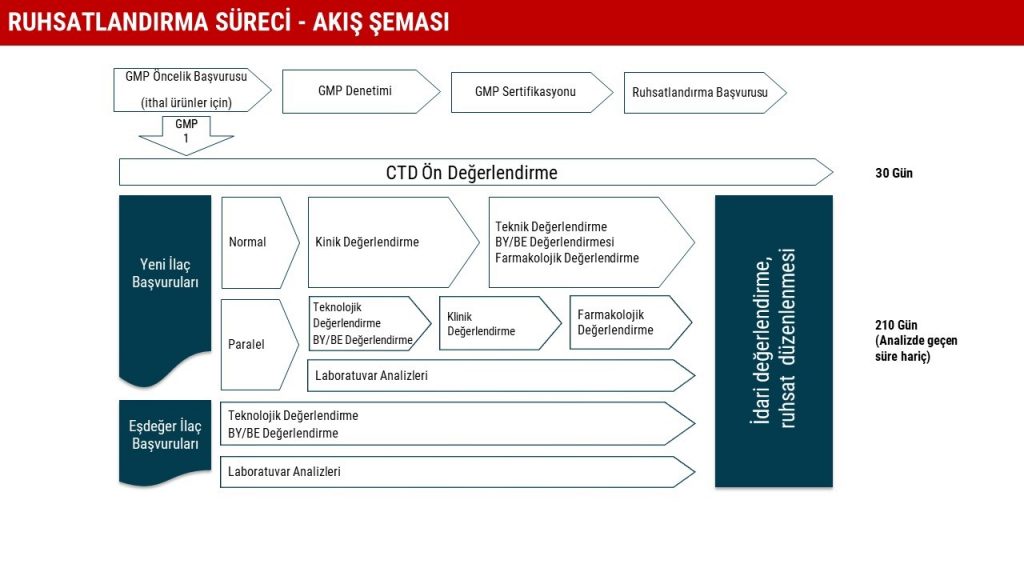
Aşılar da dâhil bir ilacın, patentle korunup korunmamasından bağımsız olarak, pazara sunulabilmesi için ruhsat alınması gerekir. Bunun için de söz konusu ilacın istenen etkinlik ve güvenilirliğe sahip olduğunun klinik dışı ve klinik test ve deneyler ile ispatlanması şarttır. Bu deneylerin yapılması ve inceleme süreçleri zaman alan süreçlerdir ve bir ilacın ortaya çıkışından ruhsat almasına kadar geçen süre kimi zaman on yılı bulabilir[6]. İdari makamlara ruhsat almak için gereken farmakolojik, toksikolojik testler ve klinik araştırmaların sonuçları sunulduktan sonra ruhsatlandırma nispeten kısa süre içinde yapılır.
Türkiye’de ilaçların ruhsatlandırılması 1262 sayılı İspençiyari ve Tıbbi Müstahzarlar Kanunu[7] ve bu kanuna dayanılarak çıkartılmış olan Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliği[8] çerçevesinde yapılıyor. Ruhsatlandırma süreci aşağıdaki şemada görülüyor.
Aşının erişilebilirliği sorunu ve zorunlu lisans
İnsanların sağlık hizmetlerine ve bunun bir parçası olan ilaçlara erişimlerinin önüne geçen engeller kamu sağlığı politikalarının ilgilenmesi gereken en büyük sorunların başında geliyor. Salgınlar, bulaşıcı hastalıklar, ender görülen hastalıklar söz konusu olduğunda problem daha da büyüyor. Özellikle bu sayılan hallerde karşılaşılan ilaç ve aşıların arz miktarındaki eksiklik ve/veya yüksek fiyatlar bu sorunla başa çıkılmasını güçleştiriyor.
Her fikri mülkiyet hakkında olduğu gibi, patentlerde de hak sahibi ile toplumun genel menfaatleri arasında bir dengenin bulunması gerekli. Bu dengenin bulunması adına patent sahibinin bazı haklarında sınırlamalara gidilebilmeli, özellikle kamu sağlığının söz konusu olduğu durumlarda toplumun menfaatleri ağır basmalıdır.
Nitekim bu ihtiyaç, TRIPS Antlaşması’nın 31. maddesinde ele alınıyor. Bu maddede devletin ya da devletin yetkili kıldığı kişilerin patentle korunan buluşu patent sahibinin rızası dışında da zorunlu lisans yoluyla kullanabilecekleri öngörülüyor ve bu kullanımın şartları düzenleniyor. Bu şartlardan bazıları şu şekilde:
- Zorunlu lisansın kapsamı, şartları ve süresi her somut olayın özelliğine göre ayrı ayrı tespit edilmelidir.
- Salgın gibi olağanüstü hallerde zorunlu lisans için daha önceden patent sahibinden kullanım için talepte bulunmuş olmaya gerek yoktur. Ancak patent sahibinin en kısa zamanda ve uygun şekilde durumdan haberdar edilmesi gerekmektedir.
- Zorunlu lisans münhasır (ayrıcalıklı, exclusive) olamaz. Başka talepte bulunanlara da lisans verilebilmesi ya da bizzat patent sahibinin de buluşu kullanabilmesi mümkün olmalıdır.
- Zorunlu lisans başkalarına devredilemez.
- Zorunlu lisans karşılığında, her somut olayın özelliğine ve kullanımın ekonomik değerine göre, patent sahibine makul bir ödeme yapılmalıdır.
Zorunlu lisans kural olarak buluşun, patentin tescil edildiği ülke içinde kullanılması amacıyla sınırlıdır. Bir diğer deyişle ihracat amaçlı zorunlu lisans kabul edilmez. Ancak DOHA Deklarasyonu olarak bilinen protokol ile buna bir istisna getirilmiştir. Bu bağlamda TRIPS Antlaşması’na sonradan eklenen 31bis maddesi ilaçların “uygun şartlara sahip ithalatçı ülkeye/ülkelere” ihracatı için de zorunlu lisans verilebilmesine olanak tanıyor. Böylelikle örneğin buluşun korunduğu X ülkesindeki bir şirketin, Y ülkesine ihraç edilmek üzere aşı üretmek için zorunlu lisans talep edebilmesi mümkün. Patent Y ülkesinde korunmuyorsa başkaca bir izin alınmasına gerek yok. Ancak patent ithalatçı Y ülkesinde de korunuyorsa, o ülkenin de aşının kendi topraklarında kullanılabilmesi için zorunlu lisans kararı alması gerekli.
Uygun şartlara sahip ithalatçı ülkeler derken en az gelişmiş ülkeler ile bu sistemi ithalatçı ülke olarak kullanacaklarına dair bildirimde bulunan ülkeler kastediliyor. DOHA Deklarasyonu’nda bazı ülkeler bu sistemi ithalatçı ülke olarak hiçbir zaman kullanmayacaklarını belirtiyor. Bu ülkeler Avustralya, Kanada, AB ülkeleri, ABD, Japonya, İsviçre, İzlanda, Norveç ve Yeni Zelanda gibi gelişmiş ülkeler. Bazı ülkeler ise bu sistemi ithalatçı ülke olarak sadece olağanüstü durumlarda kullanacaklarını ifade ediyor. Türkiye bu ülkeler arasında.
Türkiye’de zorunlu lisansa ilişkin düzenlemeler
TRIPS Anlaşmasının üye devletlere tanımış olduğu yetkiler doğrultusunda Türkiye de zorunlu lisanslar konusunda TRIPS ile uyumlu bazı düzenlemeler yaptı. Sınai Mülkiyet Kanunu’nun 129 ve devamı maddelerinde zorunlu lisansa ilişkin hükümler yer alıyor. Bunlardan özellikle iki tanesi konu açısından önemli.
İlk olarak kamu sağlığı ya da milli güvenlik nedeniyle kamu yararının söz konusu olduğu durumlarda, “patent konusu buluşun kullanılmaya başlanması, kullanımın artırılması, genel olarak yaygınlaştırılması, yararlı bir kullanım için ıslah edilmesinin büyük önem taşıması veya patent konusu buluşun kullanılmamasının ya da nitelik veya nicelik bakımından yetersiz kullanılmasının ülkenin ekonomik veya teknolojik gelişimi bakımından ciddi zararlara sebep olacağı hâllerde” Cumhurbaşkanınca zorunlu lisans kararı alınabilir. Bu durumda Cumhurbaşkanı doğrudan zorunlu lisans verilmesine karar verebilir. Patent sahibinin buluşu kamu yararını karşılayacak yeterlilikte ve tarzda kullanılabilmesinin mümkün olduğu durumlarda ise kanuna göre öncelik patent sahibindedir. Zorunlu lisans ancak bu şartın gerçekleşmemesi halinde söz konusu olabilir.
Diğer bir zorunlu lisans hali ise TRIPS 31bis maddesi kapsamında belirtilen şartların sağlanması hâlinde başka ülkelerdeki kamu sağlığı sorunları sebebiyle eczacılık ürünlerinin ihracatı için karar alınması. Dolayısıyla TRIPS Konseyi’nin uygun şartlara sahip ithalatçı ülke olarak kabul ettiği ülkelerde kullanılmak üzere COVID-19 aşısının Türkiye’de üretilmesi için zorunlu lisans verilmesi de mümkün olabilir.
Sonuç ve düşünceler
Uluslararası fikri mülkiyet ve patent sistemi buluş sahibinin menfaatlerini koruyup onu ödüllendirerek buluş yapmak için teşvik eder. Ancak yine bu durumun yaratabileceği sakıncaları önlemek için ulusal ve uluslararası düzeyde çeşitli mekanizmalar da oluşturulmuştur.
Özellikle kamu sağlığını etkileyen salgın gibi acil durumlarda patent sahibinin hakları kısıtlanarak buluşu üzerinde zorunlu lisans verme mecburiyeti öngörülüyor. Zorunlu lisansla devlet (bizzat kendisi ya da uygun göreceği kişiler eliyle) ilaç ve aşıların üretim ve dağıtımını yapıyor; toplumun hastalığa karşı kullanılacak ilaç ve aşılara yeterli ve uygun bedel ödeyerek erişimi sağlanıyor.
Hukuki çerçeve bu iken bir ilaç şirketinin farklı stratejiler geliştirmesinde de herhangi bir engel yok.
Bu seçeneklerin bir ucunda patent sahibinin ürettiği aşı için fahiş fiyatlar talep etmesi ya da aşının arzını kısıtlaması bulunuyor. Ne var ki, yukarıda da açıklandığı gibi dünya çapındaki zorunlu lisansa ilişkin düzenlemeler karşısında bu hukuken mümkün değil. Ayrıca mutlak ticari perspektiften bakıldığında küresel bir sağlık felaketinden kâr elde eden, fırsatçı şirket imajının yaratacağı olumsuz algı da göz ardı edilemez.
Seçeneklerin diğer ucunda ise şirketin açık yenilik (open innovation) politikasını benimsemesi var. Şöyle ki, COVID-19 aşısını geliştiren bir şirketin bunun için patent başvurusu yapma zorunluluğu yok. Ya da aşı için patent alınmış olsa dahi patent sahibinin patentten doğan engelleme haklarını kullanması şart değil. Patent sahibi patente konu olan aşıyı üretenlere karşı sessiz kalma yolunu seçebilir veya talepte bulunan herkese aşıyı üretme konusunda bedelsiz lisans vereceğini ilan edebilir.
Şirketin patent başvurusu yapmama, buluşu toplumun sınırsız serbest kullanımına açma yolunu tercih etmesi pek olası değil. Gerçekten de bu durumda şirket yaptığı buluş üzerindeki kontrolü kaybediyor ve isteyen bunu ücretsiz olarak kullanabiliyor. Böylece şirket aşıyı geliştirmenin maliyetine tek başına katlanmak zorunda kalıyor. Zorunlu lisansta bile, patent sahibine bir bedel ödeniyor ve küresel ölçekteki bir salgına karşı üretilip satılacak aşı için ödenecek bedel hiç de küçümsenemeyecek ölçüde olacaktır, şirket bunu kaybetmek istemez.
Bu iki uç arasında, şirketin hem hukuki zorunlulukları dikkate alan, hem algı hem de yoksun kalınan kâr bakımından kendisine en az zarar verecek bir strateji izlemesi gerçekçi bir varsayım olur.
Bütün seçenekler dikkate alındığında en akla yakın çözüm patent ve ruhsat sahibi şirketin çok makul şartlarla, isteyen herkese, salgın süresince aşıyı üretme konusunda sözleşmeye dayalı lisans teklif etmesi olarak görülebilir. Özellikle yaşadığımız gibi dünya çapındaki bir salgın hastalık durumunda zorunlu lisans uygulamaları kaçınılmaz görünüyor. İdari bir kararla lisans vermeye zorlanmış şirket görüntüsü halkla ilişkiler bakımından çok istenen bir durum olmasa gerek.
Patent sahibi, zorunlu lisans kararı alınmasını beklemeden genele bir lisans teklifi yaparsa, salgın süresince aşıyı toplumun erişimine açmış olacak, kamuoyu önünde olumlu bir imaj yaratacak, salgının riski ortadan kalktığında da lisans sözleşmeleri sona ereceğinden patentten doğan haklarını olması gerektiği gibi kullanmaya devam edebilecektir.
Özgür Öztürk
İTÜ İşletme Fakültesi öğretim üyesi
Kaynaklar:
[1] Türk Patent ve Marka Kurumu Patent Tescil Süreci https://www.turkpatent.gov.tr/TURKPATENT/resources/temp/522B990B-E529-4378-8287-66E77494B4FA.pdf;jsessionid=80A1C62CBF45C6E53B73BD240BD630FC (Erişim tarihi 20.04.2020)
[2] 20 Nisan 2020 tarihi itibariyle 177 ülkenin üye olduğu Paris Antlaşması https://www.wipo.int/treaties/en/ip/paris/ (Erişim tarihi 16.04.2020).
[3] 20 Nisan 2020 tarihi itibariyle 153 ülkenin üye olduğu Patent İşbirliği Antlaşması (Patent Cooperation Treaty –PCT ) https://www.wipo.int/pct/en/faqs/faqs.html (Erişim tarihi 20.04.2020)
[4] 20 Nisan 2020 tarihi itibariyle 164 ülkenin üye olduğu TRIPS Antlaşması https://www.wto.org/english/docs_e/legal_e/31bis_trips_01_e.htm (Erişim tarihi 20.04.2020)
[5] https://www.wto.org/english/docs_e/legal_e/31bis_trips_04c_e.htm#5 (Erişim tarihi 16.04.2020)
[6] AB’de ilaç ruhsatlarının verilmesinden sorumlu European Medicines Agency (EMA)’nın yapmış oldduğu açıklamaya göre Nisan 2020 itibariyle yaklaşık bir düzine aşı için klinik çalışmalar sürmektedir. Ancak EMA’ya göre bir aşının ruhsat alabilmesi ve geniş halk kitlelerinin kullanımına sunulabilmesi için en az 1 yıllık bir zaman gerekmektedir. https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines-covid-19#potential-vaccines-under-investigation-section (Erişim tarihi 20.04.2020).
[7] https://www.mevzuat.gov.tr/MevzuatMetin/1.3.1262.pdf (Erişim tarihi 20.04.2020)
[8] https://www.mevzuat.gov.tr/Metin.Aspx?MevzuatKod=7.5.7281&MevzuatIliski=0 (Erişim tarihi 20.04.2020)
[9] GMP (Good Manufacturing Practice – İyi Üretim Uygulamaları): Sağlık Bakanlığı ya da ilgili ülkenin yetkili otoritesi tarafından onaylanmış, belli bir kalite ya da standardı ifade eden üretim uygulamaları
CTD (Common Technical Document –Ortak Teknik Doküman): İlaç ruhsat başvuru sürecinde sunulması gereken, İdari Bilgiler, Kalite Bilgileri, Klinik Dışı ve Klinik Özetler, Kimyasal, Farmasötik ve Biyolojik Bilgiler, Klinik Dışı Raporlar ve Klinik Çalışma Raporlarını içeren dokümandır.
[10] Örneğin ABD’deki ruhsat onayı değerlendirme süresini kısaltan, hatta olağanüstü hallerde onaydan önce ürünü pazarlama imkânı veren düzenlemeler için bkz. https://crsreports.congress.gov/product/pdf/LSB/LSB10427 (Erişim tarihi 16.04.2020). AB’deki düzenlemeler için bkz . https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-scientific-application-practical-arrangements-necessary-implement-commission-regulation-ec/2006-conditional-marketing-authorisation-medicinal-products-human-use-falling_en.pdf (Erişim tarihi 20.04.2020).